时间:2020-07-07 23:32:20
1、选择题 同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
A.它是一种共价化合物
B.它受热时,可能会分解产生有色气体
C.这种化合物不能跟碱反应
D.它只含共价键,不含离子键
参考答案:B
本题解析:同族元素所形成的同一类型的化合物,其结构和性质往往相似,所以化合物PH4I和NH4Cl的结构和性质是相似的。NH4Cl是离子化合物,含有离子键和极性键,可与碱反应放出氨气。受热易分解放出氨气和氯化氢。所以选项B正确,PH4I受热分解生成HI,但HI不稳定,可以继续分解生成单质碘。答案B。
本题难度:一般
2、选择题 下列微粒中:① ?②
?② ?③
?③ ,④
,④ 其核外电子数相同的是( )
其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
参考答案:A
本题解析:①②③④四种微粒核外电子数分别是10、10、10、18,选A。
本题难度:简单
3、选择题 第7周期为不完全周期,若将来把这一周期元素全部排满,则下列有关第7周期元素的推论可能错误的是(? )
A.第7周期排满时有32种元素,全部是放射性元素
B.第7周期排满时最后一种元素的单质不与任何物质发生化学反应
C.第7周期第ⅦA族元素的原子序数为117,是一种金属元素
D.第7周期第ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质
参考答案:BD
本题解析:第7周期排满时最后一种元素是稀有气体元素,在一定条件下与F2可起反应;第7周期第ⅢA族元素的氢氧化物只具有碱性,而Al(OH)3具有两性。
本题难度:简单
4、填空题 (11分)甲元素的原子序数是9,乙是元素周期表第三周期中金属性最强的元素,丙元素原子核外有三个电子层,最外层电子层上有6个电子,丁元素比丙多一个质子,由此推断:
(1)甲元素在周期表中位于第二周期的_________族
(2)甲元素的气态氢化物的稳定性比HCl的_________(填“强”或“弱”)
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是_________ ,指出它所含的化学键的类型_______________________。
(4)乙元素原子半径比丙元素原子_________(填大或小)
(5)丙元素最高价氧化物的水化物的分子式是_________,它的酸性比磷酸的_________(?填“强”或“弱”)
(6)另有A,B,C三种短周期元素,A和B同周期,A和C同主族,三者的原子序数之和为41,三者的最外层电子总数为19,则推断出的元素依次为A________B________C________.(填元素符号)
参考答案:(11分) VIIA?强??过氧化钠,离子键和共价键;?大? H2SO4?强??S,Cl,O
本题解析:略
本题难度:一般
5、填空题 (12分)X、Y、Z、M是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| M | M的一种核素的质量数为63,中子数为34 |
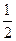 O2(g)= XO2(g)?△H =" -283.0" kJ·mol-1
O2(g)= XO2(g)?△H =" -283.0" kJ·mol-1参考答案:(12 分)(1 )S>Cl>C或 r(S)>r(Cl)>r(C),HClO4 , HCl?
(2)CS2电子式略,?2?。
(3)第 四 周期第?ⅠB 族, 1s22s22p63s23p63d104s1或[Ar]3d104s1,
2Cu2S + 3O2  ?2Cu2O+2SO2(共2分,条件1分)
?2Cu2O+2SO2(共2分,条件1分)
(4) 2CO(g)+SO2(g)==2CO2(g)+S(g) ΔH=" -" 270kJ/mol__(方程式2分 ,其余每空1分)
,其余每空1分)
本题解析:略
本题难度:一般