时间:2020-07-07 23:32:20
1、填空题 常见的10电子微粒中,分子有:_____________________(只举一例,下同),
阳离子有_________________________,阴离子有_________________________;
常见的18电子微粒中,分子有__________________________,
阳离子有___________________________,阴离子有_________________________。
参考答案:见解析。
本题解析:写10电子微粒时可以乙元素周期表为依据进行书写,遵循原子→分子→离子,所以常见的10电子微粒中,分子有:Ne、CH4、NH3、H2O、HF;阳离子有:?Na+?、Mg2+?、Al3+、NH4?+?、H3O+;阴离子有 : F-、O2-、N3-、OH-?、NH2-。在书写18电子微粒时可以在10电子微粒的基础上进行书写,其中F2是突破点,然后依据元素周期表中相邻元素原子电子数的排布进行类推即可。所以常见的18电子微粒中,分子有:Ar、 SiH4?、PH3?、H2S 、HCl 、F2、H2O2?、N2H4?、CH3F 、CH3OH 、C2H6?;阳离子有 :K+、Ca2+?;阴离子有:S2-、HS-、O22-、Cl-。
本题难度:一般
2、填空题 A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
参考答案:
(1)二?ⅣA,? N,? Cl?(每空1分)
(2)三角锥形,? 1:2?(每空1分)
(3)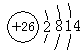 ?
?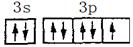 ?(3s、3p未注明也得分)
?(3s、3p未注明也得分)
1s22s22p63s23p63d104s1?或 [Ar] 3d104s1?(每空1分)
(4)2Fe3++Cu=2Fe2++Cu2+,? Be(OH)2+2NaOH=Na2BeO2+2H2O(每空2分)
本题解析:A的原子核外有6种不同运动状态的电子,即核外共有6个电子,A为碳元素。C的基态原子中s电子总数与p电子总数相等,则核外电子排布为1s22s22p4,C是氧元素。由于A、B、C原子序数依次递增,故B是氮元素。D的原子半径在同周期元素中最大,故D应为第三周期元素,是钠元素。E的基态原子最外层电子排布式为3s23p1,是铝元素。F的基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反,说明p轨道上有5个电子,是氯元素。G的基态原子核外有7个能级且能量最高的能级上有6个电子,则其电子排布式为1s22s22p63s23p64s23d6,是铁元素。H是我国使用最早的合金中的最主要元素,是铜元素。
本题难度:一般
3、选择题 下列事实不能用来说明Cl非金属性比S强的是
A.气态HCl比H2S稳定
B.HCl酸性比H2SO3强
C.还原性:S2-比Cl-强
D.Cl2通入NaBr溶液中生成Br2
参考答案:BD
本题解析:A 能说明,氯的半径比硫小,非金属性比S强。
B 不能说明,应比较最高价含氧酸的酸性,酸性越强,非金属性越强。
C 能说明,S2-比Cl-强,说明硫离子半径比氯离子半径大,非金属性就弱。
D 不能说明,是比较氯和溴的非金属性,而不是比较氯和硫的非金属性。
本题难度:一般
4、选择题 在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素
参考答案:D
本题解析:短周期元素中,原子最外电子层只有1个或2个电子的元素,可以是H或He,也可以是Na或Mg等,所以答案选D。
本题难度:一般
5、选择题 元素性质呈周期性变化的原因是 (? )
A.相对原子质量逐渐增大
B.核电荷数逐渐增大
C.原子核外电子排布呈周期性变化
D.元素的化合价呈周期性变化
参考答案:C
本题解析:A、元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B、原子序数在数值上等于这种原子的核电荷数,随着原子序数递增,核电荷数逐渐增大,但不出现规律性的变化,故B错误;
C、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故C正确;
D、元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,化合价属于元素的性质,故D错误;
故选:C。
点评:本题要理解元素周期律的实质,元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
本题难度:简单