时间:2020-07-07 23:31:58
1、填空题 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。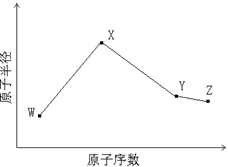
(1)Y在周期表中的位置是??。
(2)用电子式解释X与W能形成化合物X3W的原因?。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是?。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是?。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g)  2A(g)? △H =-92.4 kJ?mol―1?
2A(g)? △H =-92.4 kJ?mol―1?
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
2、选择题 下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是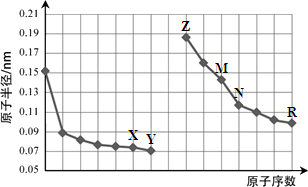
A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X > Z > M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质不能从M与R元素构成的盐溶液中置换出单质M
3、填空题 (12分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Z的空间构型为?。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是?。
(3)1mol气态Z与O2反应生成液态W和一种由两种元素组成的气体物质,放出的热量为QkJ,写出该反应的热化学方程式:?。
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1—T2之间,反应的化学方程式是:?。
②温度在T2—T3之间,气体的平均相对分子质量是(保留1位小数)?。
③若将实验所得的平衡 混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气?L。(设空气组成为:N2与O2,体积比4:1)
混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气?L。(设空气组成为:N2与O2,体积比4:1)
4、选择题 下列互为同位素的是(? )
A.Na和Na+
B.35Cl 和37Cl
C.14N 和14C
D.O2和O3
5、选择题 A、B两元素的原子,分别获得两个电子形成稀有气体元素原子的电子层结构时,A放出的能量大于B放出的能量。C、D两元素的原子,分别失去一个电子,形成稀有气体元素原子的电子层结构时,D吸收的能量大于C吸收的能量。则B、A和C、D分别形成的化合物,属于离子化合物可能性最大的是(? )
A.C2A?B.C2B? C.D2A? D.D2B