时间:2020-07-07 23:26:17
1、选择题 关于下列四个图像的说法正确的是? 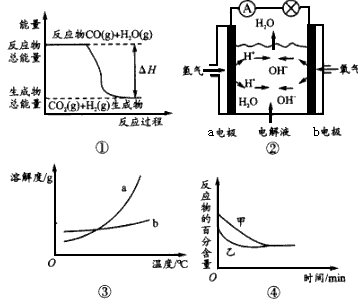
[? ]
A.图①表示化学反应中能量的变化,反应CO(g)+ H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方 法从a、b混合物提纯a
D.图④可以表示压强对可逆反应2A(g)+ 2B(g) 2C(g) +D(s)的影响,且乙的压强大
2C(g) +D(s)的影响,且乙的压强大
参考答案:C
本题解析:
本题难度:一般
2、选择题 有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
[? ]
A.氧化剂和还原剂的物质的量之比为1∶8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
参考答案:C
本题解析:
本题难度:简单
3、填空题 (共10分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
(1)通入甲烷的一极作原电池的____极(填“正”或“负”)
(2)闭合K开关后,a、b电极上均有气体产生,其中b极得到的气体是____。
(3)该甲烷燃料电池中,负极反应式为________,正极反应式为_________________。
(4)甲烷燃料电池工作时,若某一电极上消耗11.2 L(标准状况下)的CH4气体,线路中转移电子的个数是____。
参考答案:(每空2分,共10分)
(1)负 (2)H2 (3)CH4+10OH--8e-=CO32-+7H2O 2O2+4H2O+8e-=8OH- (4)4NA
本题解析:(1)甲烷燃料电池属于原电池,原电池中负极失去电子,正极得到电子,所以甲烷在负极通入,
氧气在正极通入。
(2)闭合K开关后,b电极和电源的负极相连,作阴极,溶液中的氢离子放电,生成氢气。
(3)甲烷燃料电池中,甲烷在负极失电子生成CO2,CO2和KOH溶液反应生成K2CO3,负极反应的离子方程式为CH4+10OH--8e-=CO32-+7H2O,氧气在正极得电子,在KOH环境下生成OH-,正极反应式为2O2+4H2O+8e-=8OH-。
(4)甲烷在反应中失去8个电子,11.2L甲烷的物质的量为11.2/22.4=0.5mol, 线路中转移电子的个数是0.5×8×NA=4NA。
考点:考查甲烷燃料电池,原电池、电解池的工作原理。
本题难度:困难
4、选择题 两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是(?)
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2 溶液 | H2SO4溶液 | CuSO4 | NaOH溶液 |
参考答案:C
本题解析:
选项
能否
理由
A
能
Zn为负极,Cu为正极,自发的氧化还原反应:Zn+Cu2+=Cu+Zn2+
B
能
Zn为负极,Fe为正极,自发的氧化还原反应:Zn+2H+=Zn2++H2↑
C
不能
无自发进行的氧化还原反应
D
能
Al为负极,C为正极,自发的氧化还原反应:2Al+2OH-+2H2O=2AlO+3H2↑
本题难度:简单
5、选择题 铁-镍蓄电池放电和充电时发生的反应为:
Fe + NiO2 +2H2O  Fe(OH)2 + Ni(OH)2?
Fe(OH)2 + Ni(OH)2?
关于此蓄电池的下列说法中不正确的是?
A.放电时铁为负极
B.充电时阴极的电极反应式为:Ni(OH)2-2e- = NiO2 +2H+
C.放电时NiO2的反应为:NiO2 + 2H2O +2e- = Ni(OH)2 + 2
D.蓄电池的电极必须浸在碱性电解质溶液中
参考答案:B
本题解析:首先分析放电,为原电池,Fe失电子,发生氧化反应为负极;NiO2得电子,化合价降低,发生还原反应,故AC正确;充电为电解池,阴极还原反应,得电子,故B错误。生成物为氢氧化亚铁和氢氧化镍,故电解质溶液为碱性。
本题难度:一般