时间:2020-07-07 23:23:30
1、计算题 (8分)某研究性学习小组用48.0克铜屑与氧化铜的混合物与硫酸和硝酸的混酸100 ml溶液反应制取五水硫酸铜晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后溶液中只有硫酸铜。若在固体混合物中铜屑的质量分数为0.4,试计算:(1)最终制得晶体的质量。(2)混酸中两溶质的物质的量浓度。
参考答案:(8分)(1)165g(4分)?(2)CHNO3=2mol/L? CH2SO4=6.6mol/L(各2分)
本题解析:略
本题难度:一般
2、选择题 中学所学的A、B、C三种物质都是由H、O、S、Na中的三种元素组成的强电解质。A、B的水溶液均呈碱性,测得pH相等的A、B溶液c(A)<c(B);C的水溶液呈酸性。有关说法正确的是
A.A是Na2SO3?
B.? B溶于溴水中,不可能生成沉淀
C.? B、C反应的离子方程式可能是:SO3-+2H+→ SO2↑+H2O
D.?若A、B两溶液的pH=9,则两溶液中水电离的OH-的物质的量浓度之比为1:1
参考答案:C
本题解析:显碱性的物质可能是NaOH、Na2SO3、NaHS,pH相等的A、B溶液c(A)<c(B),说明A是NaOH,B是Na2SO3(或NaHS)。C的水溶液显酸性且为强电解质,应为硫酸;若B为NaHS,与溴水发生反应(HS-+Br2=S↓+2Br-+H+)会生成S沉淀;A为NaOH,水电离的OH-与溶液中H+浓度相同,为10-9?mol/L。B为能水解的盐,溶液中的OH-全部由水电离,其浓度为10-5?mol/L,故二者之比为1:104.A、A是NaOH,故A错误;B、若B为NaHS,与溴水发生反应(HS-+Br2=S↓+2Br-+H+)会生成S沉淀;故B错误;C、依据推断,B、C反应的离子方程式可能是:SO32-+2H+=SO2↑+H2O,故C正确;D、A为NaOH,水电离的OH-与溶液中H+浓度相同,为10-9?mol/L,B为能水解的盐,溶液中的OH-全部由水电离,其浓度为10-5mol/L,故二者之比为1:104;故D错误,答案选C。
本题难度:一般
3、实验题 已知盐酸加到品红溶液中,使品红溶液的红色加深。试推测: (1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。
(1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。 (2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。 (3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
(3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
参考答案: (1)溶液颜色先变深后又逐渐褪去?逐渐恢复原来的红色。
(1)溶液颜色先变深后又逐渐褪去?逐渐恢复原来的红色。 (2)溶液的颜色先变深后又逐渐褪去,不再恢复红色(或仍为无色)。
(2)溶液的颜色先变深后又逐渐褪去,不再恢复红色(或仍为无色)。 (3)溶液的红色比原来加深。
(3)溶液的红色比原来加深。
本题解析:当向品红溶液中通入过量的SO2时,发生如下反应:SO2+H2O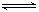 H2SO3,生成的酸能使品红溶液红色加深,因SO2过量,SO2与品红溶液结合成不稳定的无色物质而褪色,加热,无色物质分解又逐渐恢复到原来的红色。当向品红溶液中通入Cl2,因Cl2+H2O
H2SO3,生成的酸能使品红溶液红色加深,因SO2过量,SO2与品红溶液结合成不稳定的无色物质而褪色,加热,无色物质分解又逐渐恢复到原来的红色。当向品红溶液中通入Cl2,因Cl2+H2O
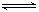 HClO+HCl同样生成了酸,品红溶液红色加深,因Cl2过量,Cl2氧化有色物质而褪色,加热后不再恢复红色,当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O
HClO+HCl同样生成了酸,品红溶液红色加深,因Cl2过量,Cl2氧化有色物质而褪色,加热后不再恢复红色,当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O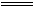 2HCl+H2SO4,因生成了酸,使品红溶液颜色加深。
2HCl+H2SO4,因生成了酸,使品红溶液颜色加深。
本题难度:一般
4、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应,下列有关说法不合理的是(?)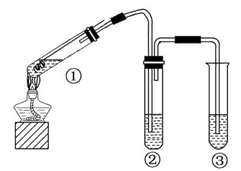
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:本题是考查铜和浓硫酸反应的实验,意在考查考生对化学实验原理的分析能力。上下移动铜丝可以控制铜与浓硫酸的接触面积的大小,从而可以控制反应生成SO2的量,A项正确;SO2可使品红溶液褪色,因此B项正确;SO2有毒,能与NaOH溶液反应,因此C项正确;铜与浓硫酸反应后①中溶液显蓝色即可证明有CuSO4生成,无需向其中加水,并且将水加入浓硫酸中会使试管中液滴飞溅,发生危险,D项错误。
本题难度:一般
5、选择题 已知某物质X能发生如下转化: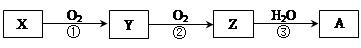
下列有关上述转化关系中物质及其反应的叙述错误的是
A若X?N2或NH3(催化氧化),则A为硝酸
B若X为S 或H2S(完全燃烧),则A为硫酸
C若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
参考答案:D
本题解析:A若X为N2或NH3,则Y是NO,Z是NO2,A是HNO3,A正确;
B若X为S 或H2S(完全燃烧),则Y是SO2,Z是SO3,A为硫酸,B正确;
C若X为非金属单质或非金属氢化物,则有两种可能,如X含有氮元素或硫元素,如果含有硫元素,则A是“稀”的就不与金属铜反应生成Y,C正确。
D由上述分析可知,反应①和②一定为氧化还原反应,但③不一定为非氧化还原反应,如果Z是NO2,它与水反应就是氧化还原反应,D错。
本题难度:一般