时间:2020-07-07 23:21:27
1、选择题 下列电子层中具有的能量最低的是(? )
A.K层
B.L层
C.M层
D.N层
参考答案:A
本题解析:离核越近的电子能量越低,据此可知,选项A正确。
点评:该题主要是考查学生对核外电子运动状态的熟悉了解程度,侧重对教材基础知识的巩固和训练,难度不大,记住即可。
本题难度:简单
2、填空题 (12分)①~⑧是元素周期表中的部分元素。
 族 族周期 | IA | ? | 0 | |||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | ? |
| 2 | ? | ? | ? | ② | ? | ③ | ④ | ? |
| 3 | ⑤ | ⑥ | ⑦ | ? | ? | ? | ⑧ | ? |

参考答案:(1)HF(1分,写F不给分)
(2) (2分,写化学方程式或没配平不给分)
(2分,写化学方程式或没配平不给分)
(3)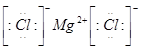 (1分)?(4)a.
(1分)?(4)a.  (1分)
(1分)
吸收 中混有的
中混有的 气体(1分)? b. C中产生白色胶状沉淀(1分)
气体(1分)? b. C中产生白色胶状沉淀(1分) (2分,写
(2分,写 、离子方程式均给分)
、离子方程式均给分)
电子层数逐渐增加,原子半径逐渐增大(1分,任答一点即可)
(5)取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。(2分,未注明酸浓度相同扣1分,其他合理答案,如与热水、原电池、最高价氧化物的水化物的碱性比较等酌情给分,但答成原理不给分)
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑧分别是H、C、O、F、Na、Mg、Al、Cl。
(1)非金属性越强相应氢化物的稳定性越强,所以应该是HF。
(2)氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,方程式为 。
。
(3)镁和氯都是活泼的金属和非金属,二者形成的化学键是离子键,电子式为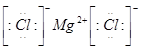
(4)A装置是产生CO2的,但由于生成CO2分子中含有氯化氢,而氯化氢也能和硅酸钠反应,所以需要除去CO2中的氯化氢,因此X是碳酸氢钠,原来吸收 中混有的
中混有的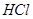 气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为
气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为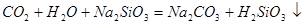 。
。
(5)考查金属性强弱比较。比较元素金属性强弱的依据可以是
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
即取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。
本题难度:一般
3、填空题 (11分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| ?主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ? | ? | ? | ① | ② | ③ | ? | ? |
| 3 | ④ | ? | ⑤ | ? | ? | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | ? | ? | ? | ? | ? | ? | ? |
参考答案:(1 ) 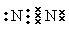 , Ar? (2) HClO4,?
, Ar? (2) HClO4,?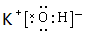 。 (3) C?
。 (3) C?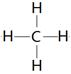
(4) Al;Al2O3+2OH-=2AlO2-+H2O
(5)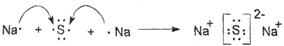 ,?离子化合物
,?离子化合物
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑨元素分别是C、N、O、Na、Al、S、Cl、Ar、K。稀有气体的最外层电子数已经达到稳定结构,所以Ar的性质最稳定,金属性越强,最高价氧化物的水化物的碱性越强,同样非金属性越强,最高价氧化物的水化物的酸性越强,因此分别是KOH和HClO4。
本题难度:一般
4、选择题 下列多电子原子的原子轨道能量高低顺序正确的是?(?)
A.2s > 3s
B.2s > 2d
C.2px < 2Py
D.2px = 2py
参考答案:D
本题解析:略
本题难度:简单
5、填空题 锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示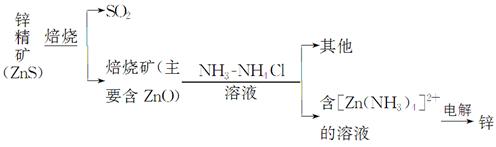
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。
参考答案:(1)2ZnS+3O2 2SO2+2ZnO
2SO2+2ZnO
(2)[Zn(NH3)4]2++2e-=Zn+4NH3↑
(3)ZnO+2OH-+H2O=[Zn(OH)4]2-
(4)增大了负极的反应面积,提高了放电效率 2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(5)Zn-2e-+2OH-=ZnO+H2O 2.8(2.7也可)
本题解析:(2)析锌一极应是[Zn(NH3)4]2+得到电子,还原为锌,同时释放出氨气。(4)碱性锌锰电池中,负极锌失电子生成锌离子,再与溶液中的氢氧根结合生成氢氧化锌,负极反应:Zn+2OH--2e-=Zn(OH)2,正极反应:2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(5)锌空电池的负极反应式为2Zn-4e-+4OH-=2ZnO+2H2O,正极反应式为O2+4e-+2H2O=4OH-,用惰性电极电解硝酸银溶液的阴极反应式为Ag++e-=Ag,则有O2~4e-~4Ag,V(空气)=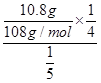 ×22.4 L·mol-1=2.8 L。
×22.4 L·mol-1=2.8 L。
本题难度:一般