时间:2020-07-07 23:15:48
1、选择题 以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:( )
a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M
①氧化剂是H3AsO3; ②M为OH-;
③每生成7.5gAs,还原剂失去的电子为0.3 mol; ④ SnCl62-是氧化产物。
A.①③④
B.①②④
C.①②③④
D.只有①③
参考答案:A
本题解析:Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3;
由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O
故每生成7.5gAs,还原剂SnCl2失去的电子为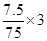 =0.3mol
=0.3mol
由于溶液为强酸性溶液,M不可能为OH—,排除②
答案为A
本题难度:一般
2、选择题 一种酸性较强的溶液中,可能存在NO3—、I-、Cl-和Fe3+中的一种或几种,向该溶液中加入溴水后,溴单质被还原,由此可推知这种溶液中( )
A.含I-,不能确定是否含Cl-
B.含NO3—
C.含I-、NO3—、Cl-
D.含Fe3+
参考答案:A
本题解析:溴单质被还原,所以必须含有还原性离子碘离子。由于铁离子能氧化碘离子,所以铁离子一定不存在。在酸性溶液中,NO3—也能氧化碘离子,所以NO3—一定不存在。所以正确的答案是A。
本题难度:一般
3、选择题 下列表示物质结构的化学用语或模型正确的是(? )?
A.8个中子的碳原子的符号:12C
B.NaCl的电子式: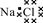
C.Cl—的结构示意图: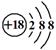
D.CH4分子的比例模型:
参考答案:D
本题解析:A、碳元素的质子数为6,8个中子的碳原子质量数为6+8=14,所以8个中子的碳原子符合为614C,故A错误;
B、氯化钠是离子化合物,由钠离子与氯离子构成,电子式为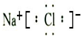 ,故B错误;
,故B错误;
C、氯离子核内有17个质子,含有有17个电子,结构示意图为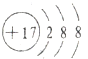 ,故C错误;
,故C错误;
D、选项中表示C原子与H原子的相对比例大小,表示原子之间的连接顺序,空间结构为正四面体,故D正确。
故选:D。
点评:考查常用化学用语的书写,难度不大,注意掌握常用化学用语的书写原则、比例模型与球棍模型的区别与联系。
本题难度:一般
4、计算题 (10分)“铜都”安徽铜陵有许多黄铜矿(主要成分为CuFeS2,含少量Al2O3、SiO2),黄铜矿是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)火法炼铜首先要焙烧黄铜矿,其反应原理为2CuFeS2+O2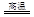 Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,被还原的元素是 (填元素符号),若反应中转移0.3mol电子时,则标准状况下产生SO2的体积为 L。
Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,被还原的元素是 (填元素符号),若反应中转移0.3mol电子时,则标准状况下产生SO2的体积为 L。
(2)焙烧黄铜矿产生的Cu2S可被稀硝酸氧化为Cu2+ 和硫单质,HNO3的还原产物为NO,试写出Cu2S与稀硝酸反应的离子方程式 ,该反应中稀硝酸体现 (填“氧化性”、“还原性”或“酸性”)。
(3)焙烧黄铜矿还可得到Cu2O。将21.6g Cu2O加入到500mL某浓度的稀硝酸中,固体物质完全反应,生成Cu(NO3)2和NO,在所得溶液中加入1.0mol?L-1的NaOH溶液1.0L,此时溶液呈中性。原硝酸的物质的量浓度为 。
参考答案:(1) Cu、O(2分) 1.12(2分) (2)3Cu2S+16H++4NO3-==6Cu2++3S↓+4NO↑+8H2O
氧化性、酸性(每空2分) (3) 2.2mol?L-1(每空2分)
本题解析:(1)CuFeS2中Cu和Fe元素的化合价均为+2价,则S元素的化合价是—2价。根据方程式2CuFeS2+O2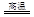 Cu2S+2FeS+SO2可知,在反应中铜元素的化合价从+2价降低到+1价,得到1个电子,氧元素的化合价从0价降低到—2价,得到2个电子,则被还原的元素是Cu、O。S元素的化合价部分从—2价升高到+4价,失去6个电子,因此若反应中转移0.3mol电子时,则标准状况下产生SO2的物质的量为0.3mol÷6=0.05mol,体积为0.05mol×22.4L/mol=1.12L。
Cu2S+2FeS+SO2可知,在反应中铜元素的化合价从+2价降低到+1价,得到1个电子,氧元素的化合价从0价降低到—2价,得到2个电子,则被还原的元素是Cu、O。S元素的化合价部分从—2价升高到+4价,失去6个电子,因此若反应中转移0.3mol电子时,则标准状况下产生SO2的物质的量为0.3mol÷6=0.05mol,体积为0.05mol×22.4L/mol=1.12L。
(2)焙烧黄铜矿产生的Cu2S可被稀硝酸氧化为Cu2+ 和硫单质,则1mol硫化亚铁失去4mol电子。HNO3的还原产物为NO,氮元素得到3个电子,因此根据电子得失守恒可知Cu2S与稀硝酸反应的离子方程式为3Cu2S+16H++4NO3-==6Cu2++3S↓+4NO↑+8H2O;该反应中有NO和硝酸铜产生,因此稀硝酸体现氧化性和酸性。
(3)21.6g Cu2O的物质的量是21.6g÷144g/mol=0.15mol,加入到500mL某浓度的稀硝酸中,固体物质完全反应,生成Cu(NO3)2和NO,因此反应中转移0.3mol电子,则根据电子得失守恒可知NO是0.3mol÷3=0.1mol,即被还原的硝酸是0.1mol。在所得溶液中加入1.0mol?L-1的NaOH溶液1.0L,此时溶液呈中性,这说明溶液中的铜离子转化为氢氧化铜沉淀,溶质是硝酸钠,根据钠离子守恒可知硝酸钠的物质的量是1mol,则未被还原的硝酸是1mol。原硝酸的物质的量浓度为(1mol+0.1mol)÷0.5L=2.2mol/L。
考点:考查氧化还原反应的应该判断与计算
本题难度:困难
5、选择题 下列化学用语表示正确的是?(?)
A.含18个中子的氯原子的核素符号: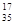 C1
C1
B.氟原子结构示意图: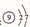
C.1 -丙醇的结构简式:C3 H7OH
D.CO( NH2)2的电子式: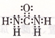
参考答案:D
本题解析:A、含18个中子的氯原子的核素符号: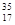 C1;B、氟原子结构示意图中圆圈(原子核)中应为+9,表示有9个质子且质子带正电荷;C、1 -丙醇的结构简式:C H3CH2CH2OH;
C1;B、氟原子结构示意图中圆圈(原子核)中应为+9,表示有9个质子且质子带正电荷;C、1 -丙醇的结构简式:C H3CH2CH2OH;
本题难度:一般