时间:2020-07-07 23:12:18
1、实验题 (12分)如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: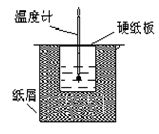
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
2、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反
应原理是 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=" +" 49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol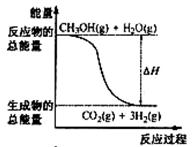
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH > -192.9kJ/mol
3、选择题 下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ/mol
B.C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ/mol
C.H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ/mol
D.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l)ΔH=-11036 kJ/mol
4、选择题 下列描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H= + 2×283.0 kJ·mol-1
C.牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀
D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH
5、选择题 用石墨作电极,电解质溶液中各离子浓度之比如下:c(Cu2+):c(Na+):c(Cl—)=1:2:4。在任何情况下,阴阳两极不可能同时发生的反应是(?)
A.阴极:2H++ 2e—=H2↑阳极:4OH——4e—=O2↑+2H2O
B.阴极:Cu2++2e—=Cu阳极:4OH——4e—=O2↑+2H2O
C.阴极:2H++2e—=H2↑阳极:2C1——2e—=Cl2↑
D.阴极:Cu2++2e—=Cu阳极:2C1——2e—=Cl2↑