时间:2020-07-07 23:11:14
1、选择题 以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);
ΔH=-1300kJ/mol的说法中,错误的是
[? ]
A.有10NA个电子转移时,放出1300kJ的能量
B.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
C.C2H2的燃烧热为1300kJ/mol
D.该热化学方程式还可表示为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2600 kJ/mol
2、选择题 已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是
A.等温浓度均为0.1 mol·L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB)
B.在0.1mol·L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+)
C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多
D.等温浓度均为0.1 mol·L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
3、选择题 常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是(?)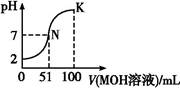
A.HA可能为一元弱酸
B.MOH为一元强碱
C.N点水的电离程度小于K点水的电离程度
D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)="0.01" mol·L-1
4、选择题 25℃、101 kPa下,1 mol 氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) = 2H2O(1)△H= ―285.8kJ/mol
B.2H2(g)+ O2(g) = 2H2O(1)△H= +571.6 kJ/mol
C.2H2(g)+O2(g) = 2H2O(g)△H= ―571.6 kJ/mol
D.H2(g)+ 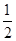 O2(g) = H2O(1)△H= ―285.8kJ/mol
O2(g) = H2O(1)△H= ―285.8kJ/mol
5、选择题 T℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是?
A.此时水的离子积Kw=1×10-12
B.水电离出的c(H+)=1×10-10 mol/L
C.水的电离度随温度升高而增大
D.若加入等体积pH=12的NaOH溶液,溶液呈中性