时间:2020-07-07 23:10:25
1、选择题 为除去MgCl2酸性溶液中的Fe3+,不可以使用的试剂是(已知:Mg(OH)2的Ksp:5.6×10?-12,Fe(OH)3的Ksp:4.0×10?-38?)( )
A.NH3?H2O
B.MgO
C.Mg(OH)2
D.MgCO3
参考答案:A、加入NH3?H2O会使铁离子沉淀和镁离子沉淀,起不到提纯的作用,故A不用;
B、加入MgO发生的反应为MgO+2H+=Mg2++H2O,氢离子浓度减小铁离子水解促进生成氢氧化铁沉淀,不引入新的杂质,故B可以用;
C、加入Mg(OH)2发生的反应Mg(OH)2+2H+=Mg2++2H2O,氢离子浓度减小铁离子水解促进生成氢氧化铁沉淀,不引入杂质,故C可以用;
D、加入MgCO3发生的反应MgCO3+2H+=Mg2++CO2↑+H2O,氢离子浓度减小铁离子水解促进生成氢氧化铁沉淀,不引入杂质,故D可以用;
故选A.
本题解析:
本题难度:简单
2、选择题 向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是
[? ]
A.AgCl的溶解度增大
B.AgCl的溶解度、Ksp均不变
C.Ksp(AgCl)增大
D.AgCl的溶解度、Ksp均增大
参考答案:B
本题解析:
本题难度:一般
3、选择题 已知Ksp(BaSO4?)=1.1×10-10,Ksp(BaCO3)=2.5×10-9.下列说法中不正确的是( )
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/c(CO32-)=4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6?mol?L-1
参考答案:A.难溶电解质的溶解平衡中,溶度积大的能向溶度积小的转化所以,BaCO3可以转化为BaSO4;故A正确;
B.因胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,Ba2+有毒,所以BaCO3不可以做钡餐试剂,故B错误;
C.根据Ksp(BaSO4 )和Ksp(BaCO3)计算可求出c(SO42-)/c(CO32-)=Ksp(BaSO4?)Ksp(BaCO3)=4.4×10-2;故C正确;
D.Ksp(BaCO3)=c(CO32-)?c(Ba2+)=2.5×10-9,所以c(Ba2+)=5×10-5? Qc=c(SO42-)?c(Ba2+)≥Ksp(BaSO4 )开始转化为BaSO4,所以c(SO42-)=Ksp(BaSO4?)c(Ba2+)=1.1×10-105×10-5=2.2×10-6 mol?L-1;故D正确;
故选B.
本题解析:
本题难度:一般
4、计算题 (20分)难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s) Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) 2Ag++
2Ag++ 。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(
。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c( )=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
)=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
(1)Cl-、 谁先沉淀?
谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
参考答案:(1)Cl-先沉淀? (2)4.13×10-6 mol·L-1
本题解析:(1)根据两种物质的Ksp,求出生成各自的沉淀所需的c(Ag+),比较两者c(Ag+),谁需c(Ag+)小谁先沉淀。
沉淀Cl-: 。
。
沉淀 :
: 。
。
故先生成AgCl沉淀。
(2)因[c(Ag+)]2·c( )=1.9×10-12,[c(Ag+)]2×0.001 mol·L-1=1.9×10-12,c(Ag+)=4.36×10-5 mol·L-1,c(Ag+)·c(Cl-)=1.8×10-10,4.36×10-5·c(Cl-)=1.8×10-10,c(Cl-)=4.13×10-6 mol·L-1。
)=1.9×10-12,[c(Ag+)]2×0.001 mol·L-1=1.9×10-12,c(Ag+)=4.36×10-5 mol·L-1,c(Ag+)·c(Cl-)=1.8×10-10,4.36×10-5·c(Cl-)=1.8×10-10,c(Cl-)=4.13×10-6 mol·L-1。
本题难度:简单
5、选择题 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是 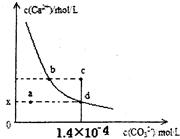
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成 a点
D.b点与d点对应的溶度积相等
参考答案:C
本题解析:略
本题难度:一般