时间:2020-07-07 23:10:04
1、选择题 已知某亚铁盐的化学式可表示为(NH4)a Feb(S04)c。取一定质量的该亚铁盐样品全部溶于足量的水中,将所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32 g。另一份溶液同足量的浓NaOH溶液共热,产生的氨气用100 mL 0.5mo1·L-1稀硫酸吸收后(设产生的氨全部逸出),剩余的硫酸再用1.5 mol·L-1NaOH溶液中和,需NaOH溶液40mL。该亚铁盐样品中b:c的比值为
A.1:1
B.2:1
C.1:2
D.3:2
参考答案:C
本题解析:根据第一组反应计算硫酸根离子的量,n(SO42-)= n(BaSO4)=9.32÷233=0.04mol
根据第二组反应计算铵根离子的量,n(NH4+)=2n(H2SO4)=2(0.5×0.1-1.5×0.04÷2)=0.04mol
根据电荷守恒得2n(SO42-)= n(NH4+)+ 2n(Fe2+),n(Fe2+)=(0.04×2-0.04)÷2=0.02mol
所以b:c=0.02:0.04=1:2
本题难度:一般
2、选择题 设NA代表阿伏加德罗常数的值,下列说法正确的是?
A.常温常压下,11.2 L氧气所含的O原子数为NA
B.1mol/L的CaCl2溶液中含有的Cl-为2NA
C.2.4g镁变成Mg2+时失去的电子数目为0.2NA
D.标准状况下,2g氢气所含原子数目为NA
参考答案:C
本题解析:A项11.2L氧气在常温常压下不能按22.4L·mol-1进行换算,所以错误。B项不知溶液的体积,所以计算不出Cl-的物质的量。C项2.4g镁的物质的量为0.1mol,又知道一个Mg原子变成一个Mg2+时失去的电子数是2个,所以0.1molMg变成Mg2+时失去的电子数目为0.2NA,正确。D项2g氢气的物质的量为1mol,含原子数应为2NA。
点评:熟记以物质的量为中心的计算公式,注意气体的标准状况,此类题属中等难度题型。
本题难度:一般
3、选择题 用固体氢氧化钠配制一定物质的量浓度溶液时,下列操作能导致溶液浓度偏低的是( )
A.在烧杯中溶解时,有少量液体溅出
B.样品中混有碳酸钠固体
C.容量瓶使用前未经干燥
D.定容时俯视容量瓶刻度线
参考答案:AB
本题解析:
本题难度:一般
4、选择题 设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5 mol过氧化钠含有NA个阴离子
B.标准状况下,22.4LC2H6中含有7NA个共价键
C.在1L0.1 mol/L碳酸钠溶液中,阴离子总数小于0.1 NA
D.58.5g的氯化钠固体中含有NA个氯化钠分子
参考答案:B
本题解析:A不正确,过氧化钠中阴离子和阳离子的个数之比是1︰2,因此0.5mol过氧化钠中阴离子是0.5mol;碳酸钠在溶液中存在水解平衡,方程式为CO32-+H2O HCO3-+OH-。根据方程式可知,每消耗1个CO32-,生成2个阴离子,所以在1L0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NA;氯化钠是离子化合物,不存在分子,D不正确,答案选B。
HCO3-+OH-。根据方程式可知,每消耗1个CO32-,生成2个阴离子,所以在1L0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NA;氯化钠是离子化合物,不存在分子,D不正确,答案选B。
本题难度:一般
5、选择题 150 ℃时,碳酸铵完全分解,生成的气态混合物密度是相同条件下H2密度的( )
A.96倍
B.48倍
C.24倍
D.12倍
参考答案:D
本题解析:根据(NH4)2CO3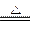 2NH3↑+H2O↑+CO2↑,设有1 mol (NH4)2CO3即96 g,完全分解,共生成气体4 mol,根据质量守恒
2NH3↑+H2O↑+CO2↑,设有1 mol (NH4)2CO3即96 g,完全分解,共生成气体4 mol,根据质量守恒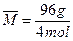 ="24" g·mol-1,其密度是相同条件下H2的24÷2=12(倍)。
="24" g·mol-1,其密度是相同条件下H2的24÷2=12(倍)。
本题难度:一般