时间:2020-07-07 23:10:04
1、选择题 下列有关气体的叙述中,错误的是(? )
A.不同的气体,若体积不同,则它们所含的分子数肯定不同
B.在标准状况下,气体的摩尔体积约为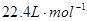
C.当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离
D.一定温度和压强下,气体分子的物质的量决定了它们的体积
参考答案:A
本题解析:体积与温度和压强有关,当温度压强不同时,体积不同的气体分子数也可以相同,A错误。其他选项都正确。答案选A。
点评:气体的体积受温度和压强影响,不标明温度和压强时,不能指明气体的体积。
本题难度:简单
2、计算题 用100g 9.8% H2SO4溶液和足量金属Zn反应,可以得到标准状况下气体多少升?(要求有简要步骤)
参考答案:2.24L
本题解析:
本题难度:一般
3、选择题 设NA为阿伏加德罗常数,下列说法中正确的是?(?)
A.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.1mol金属钠与氧气反应,不论生成氧化钠还是过氧化钠,转移电子数都是NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 molH2时,转移的电子数为NA
参考答案:C
本题解析:标准状况下四氯化碳为液体,A项错误;14 g氮气含有1mol氮原子,共含有7mol核外电子,B项错误;氧化钠和过氧化钠中,钠的化合价都是+1价,C项正确;铝跟氢氧化钠溶液反应生成1 molH2时,转移的电子数为2NA,D项错误。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1L0.5 mol·L-1 HCl溶液中含有3.01×1023个离子
B.标准状况下,22.4 L H2O中所含分子数为NA
C.46gNO2和N2O4混合气体中含有原子数为3 NA
D.0.1 mol Fe和足量的稀硝酸充分反应,转移电子数为0.2 NA
参考答案:C
本题解析:略
本题难度:一般
5、填空题 将标准状况下的NH3 700L溶于1L的水中,所得溶液的密度为0.90g/cm3,则所得氨水的物质 的量浓度为 mol/L
的量浓度为 mol/L
参考答案:18.37 mol/L
本题解析:略
本题难度:一般