时间:2020-07-07 23:08:41
1、选择题 将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是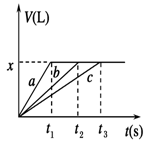
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图像
参考答案:C
本题解析:钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al。根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属再与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol。氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L,即选项A、B、D正确,C不正确,所以答案选C。
本题难度:一般
2、选择题 NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在标准状况下,11.2L NH3含有5NA个质子
B.Na2O2与CO2反应产生1molO2时,转移电子数为4NA
C.SO2、CO2、NO、NO2都是大气污染物,实验中都必须进行尾气吸收
D.明矾和漂白粉常用于自来水的净化或杀菌消毒,两者的作用原理相同
参考答案:A
本题解析:A.在标准状况下,11.2L NH3含有的分子的物质的量为0.5mol,每个NH3分子中含有10个质子,所以0.5mol mol的NH3中含有5NA个质子。正确。B.Na2O2与CO2反应方程式是2Na2O2+2CO2 =Na2CO3+ O2?,每产生1molO2时,转移电子数为2NA.错误。C.SO2、NO、NO2都是大气污染物,实验中都必须进行尾气吸收,而CO2不是大气污染物。错误。D.明矾和漂白粉常用于自来水的净化或杀菌消毒,前者是盐水解产生Al(OH)3的吸附作用;后者是盐水解产生的HClO的强氧化性,作用原理不相同。错误。
本题难度:一般
3、选择题 两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是?
A.质子总数
B.质量
C.密度
D.原子总数
参考答案:D
本题解析:
正确答案:D
D、水蒸气和二氧化碳都是三原子分子,同温同压同体积分子数相同,原子数相同,故D正确。
本题难度:一般
4、选择题 由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是( )
A.混合气体中C16O与C18O的分子数之比为14
参考答案:
本题解析:
本题难度:一般
5、填空题 Ⅰ.有以下几种物质:①食盐晶体 ②乙醇 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)
⑥KNO3溶液 ⑦熔融的氢氧化钠 ⑧液态氯化氢 填空回答(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;(2)以上物质可以导电是 ;
(3)以上物质中属于电解质的是 ; (4)以上物质中属于非电解质是 。
Ⅱ.(1)O2、SO2、SO3三者质量之比为1∶2∶5,则它们的氧原子数之比为 。
(2)某金属氯化物MCl2 40.5 g中含有0.6 mol Cl-,则MCl2的摩尔质量为 ,金属M的相对原子质量为 。(3)在V LFe2(SO4)3溶液中含有m g Fe3+,则CFe3+为_______________;从中取出V/4L溶液,则SO42-物质的量浓度为_______________;再将这V/4L溶液溶液稀释到4L,稀释后溶液中溶质的物质的量浓度为___________________。
参考答案:Ⅰ(1)①④⑤;(2)③⑥⑦;(3)①⑤⑦⑧;(4)②④
Ⅱ.(1)1:1:3 (2)135g/mol 64 (3) m/56V mol/L;3m/112V mol/L;m/1792 mol/L
本题解析:Ⅰ、(1)组成物质的微粒之间存在相互作用,各微粒之间既有相互吸引力,又有相互排斥力,当微粒距离较近时,排斥力的作用明显,将微粒推开,当微粒距离较大时,吸引力的作用明显,将微粒拉近,所以通常微粒在较平衡的位置上做极小的运动,即只能在各自平衡位置附近做微小振动,选①④⑤;(2)含有自由移动离子或电子的物质能导电,③水银 中含有自由的电子,所以能导电,⑥KNO3溶液、⑦熔融的氢氧化钠中含有自由移动的离子,所以能导电,选③⑥⑦;(3)①食盐晶体、⑤纯醋酸、⑦熔融的氢氧化钠、⑧液态氯化氢溶于水都能导电,且都是化合物,所以都是电解质,选①⑤⑦⑧;(4)②乙醇和④蔗糖在水溶液里或熔融状态下都以分子存在,所以都是非电解质,选②④。
Ⅱ.(1)根据n=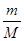 =
=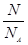 可知,O2、SO2、SO3三者质量之比为1:2:5,则O2、SO2、SO3的物质的量之比为:
可知,O2、SO2、SO3三者质量之比为1:2:5,则O2、SO2、SO3的物质的量之比为: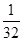 :
: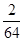 :
: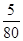 =1:1:2,它们的氧原子数之比为:1×2:1×2:2×3=1:1:3;(2)金属氯化物MCl2,40.5g中含有0.6mol Cl-,则40.5gMCl2的物质的量为:0.6mol×
=1:1:2,它们的氧原子数之比为:1×2:1×2:2×3=1:1:3;(2)金属氯化物MCl2,40.5g中含有0.6mol Cl-,则40.5gMCl2的物质的量为:0.6mol×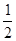 =0.3mol,则MCl2的摩尔质量为:
=0.3mol,则MCl2的摩尔质量为: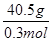 =135g/mol;M的相对原子质量为:135-35.5×2=64;(3)在V LFe2(SO4)3溶液中含有mg Fe3+,铁离子的物质的量为:
=135g/mol;M的相对原子质量为:135-35.5×2=64;(3)在V LFe2(SO4)3溶液中含有mg Fe3+,铁离子的物质的量为: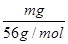 =
=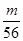 mol,铁离子的物质的量浓度为:c(Fe3+)=
mol,铁离子的物质的量浓度为:c(Fe3+)=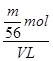 =
=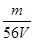 mol/L;该溶液中硫酸根离子浓度为:c(SO42-)=
mol/L;该溶液中硫酸根离子浓度为:c(SO42-)=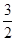 c(Fe3+)=
c(Fe3+)=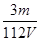 mol/L,溶液具有均一性,则从中取出
mol/L,溶液具有均一性,则从中取出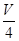 L溶液中SO42-物质的量浓度仍然为
L溶液中SO42-物质的量浓度仍然为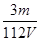 mol/L;再将这
mol/L;再将这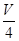 L溶液溶液稀释到4L,稀释过程中溶质的物质的量不变,稀释前Fe2(SO4)3的物质的量浓度为:c[Fe2(SO4)3]=
L溶液溶液稀释到4L,稀释过程中溶质的物质的量不变,稀释前Fe2(SO4)3的物质的量浓度为:c[Fe2(SO4)3]= 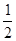 c(Fe3+)=
c(Fe3+)=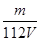 mol/L,则稀释后Fe2(SO4)3溶液中溶质的物质的量浓度为:c[Fe2(SO4)3]=
mol/L,则稀释后Fe2(SO4)3溶液中溶质的物质的量浓度为:c[Fe2(SO4)3]= 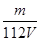 mol/L×
mol/L×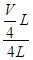 =
=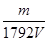 mol/L。
mol/L。
考点:考查电解质、非电解质,物质的导电性,阿伏加德罗定律及推导。
本题难度:一般