时间:2020-07-07 23:06:34
1、选择题 对基态原子的最外层电子排布式为ns2的元素的表述正确的是(?)
A.一定是金属元素
B.一定容易失电子
C.一定是主族元素
D.无法确定
参考答案:D
本题解析:最外层电子数为2的元素可能是金属,也可能是稀有气体元素He,所以答案选D。
本题难度:简单
2、选择题 下列化合物中既含有离子键又含有非极性共价键的化合物是(?)
A.CaBr2
B.NaOH
C.Na2O2
D.H2O2
参考答案:C
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键。非金属元素的原子间形成共价键,所以A中含有离子键,B中含有离子键和极性键,C中含有离子键和非极性键,D中含有极性键和非极性键。答案选C。
本题难度:一般
3、简答题 (2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5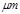 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
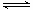 2NO(g) △H
2NO(g) △H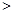 0
0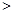 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。 参考答案:(1)PH=4
(2)①C(s)+H2O(g)=H2(g)+CO(g) △H=+131.3kJ/mol ② A B
(3)①4×10-6,温度越高,反应速率越大 ②2XCO+2NOX 2XCO2+N2
2XCO2+N2
③不能实现,因为该反应的△H>0,△S<0,所以△G>0
本题解析:
(1)根据溶液呈电中性的原理可得c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)。将各个数值代入上述式子可得c(H+)=1.0×10-4mol/L,所以pH=4;(2)① ②-①整理可得C(s)+H2O(g)=H2(g)+CO(g) △H=+131.3kJ/mol;②A.Ca(OH) 2+ SO2=CaSO3↓+H2O;正确。B.Na2CO3+ SO2=Na2SO3+ CO2。正确。C.CaCl2不反应,不能作吸收剂,错误。D.NaHSO3不反应,不能作吸收剂,错误。(3)①在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol;n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol
n(O2)=(0.2-4×10-4)mol; n(NO)= 8×10-4mol.假设气缸的容积为VL。则该温度下的平衡常数 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,是因为升高温度,化学反应速率加快。②根据已知条件结合质量守恒定律可得反应方程式为:2XCO+2NOX
。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,是因为升高温度,化学反应速率加快。②根据已知条件结合质量守恒定律可得反应方程式为:2XCO+2NOX  2XCO2+N2。③由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应。ΔH>0;△S<0,根据体系的自由能ΔG=ΔH-T·ΔS>0,.所以该设想不能实现。
2XCO2+N2。③由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应。ΔH>0;△S<0,根据体系的自由能ΔG=ΔH-T·ΔS>0,.所以该设想不能实现。
本题难度:一般
4、选择题 下列说法中,正确的是( )
A.△H>0表示放热反应,△H<0表示吸热反应
B.M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N稳定
C.l mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
参考答案:B
本题解析:△H<0表示放热反应,△H>0表示吸热反应,选项A不正确;中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以选项C不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,因此选项D不正确,答案选B。
本题难度:一般
5、选择题 在下列各说法中,正确的是
A.ΔH<0表示放热反应,ΔH>0表示吸热反应
B.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
C.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
参考答案:A
本题解析:A.按照规定,放热反应的焓变为负值,吸热反应的焓变为正值,正确;B.如果反应物所具有的总能量小于生成物所具有的总能量,则该反应是吸热反应,错误;C.在稀溶液中,强酸和强碱完全反应生成1mol水时所放出的热量,叫做中和热,错误;D.1 mol H2与0.5 mol O2反应生成液态水时放出的热就是H2的燃烧热,错误;选A。
考点:考查化学反应的热量变化,中和热和燃烧热的概念等知识。
本题难度:一般