时间:2020-07-07 23:04:15
1、填空题 (8分)水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)在水煤气燃料电池中,通CO、H2的极为电池的 极(选填“正”、“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)将标准状况下582.4L合成气[已知:n(CO)∶n(H2)= 4∶9]通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),逸出的气体中乙烯的物质的量为 。
参考答案:(1)负 (1分) (2)abc(1分) (3)N2 + 3H2 2NH3(1分)
2NH3(1分)
(4)3mol(共4分)
本题解析:(1)水煤气燃料电池中,CO、H2发生氧化反应,所以通CO、H2的极为电池的负极。
(2)a、升高温度,反应速率加快,正确;b、加入催化剂,反应速率加快,正确;c、增大压强,反应速率加快,正确,d、降低温度,反应速率减小,错误。
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为:N2 + 3H2 2NH3
2NH3
(4)标准状况下582.4L合成气物质的量为:582.4L÷22.4L/mol=26mol,则n(CO) +n(H2)= =26mol,因为n(CO)∶n(H2)= 4∶9,则n(CO)=26mol×4/(4+9)=8mol,n(H2)=26mol-8mol=18mol,由化学方程式:2CO(g)+ H2(g)→C2H4(g)+2H2O(g)和CO(g)+ 3H2(g) → CH4(g)+ H2O(g),可得:n(CH4)+2n(C2H4)="8mol" ,3n(CH4)+4n(C2H4)=18mol,解得n(C2H4)=3mol。
考点:本题考查原电池原理、影响化学反应速率的因素、化学方程式的书写与计算。
本题难度:一般
2、填空题 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: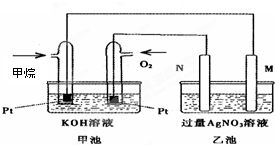
①N电极的材料是______,乙池N极的电极反应式是______.M极的电极反应式是______.
②在此过程中,乙池中某一电极析出金属银10.8g时,甲池中理论上消耗氧气为______L(标况下).
参考答案:①酸性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极反应式为Ag++e-=Ag,
故答案为:石墨;4OH--4e-=O2↑+2H2O;Ag++e-=Ag;
②n(Ag)=10.8g108g/mol=0.1mol,根据Ag++e-=Ag可知转移电子为0.1mol,
甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=14×0.1mol=0.025mol,
V(O2)=0.025mol×22.4L/mol=0.56L,
故答案为:5.6.
本题解析:
本题难度:一般
3、选择题 下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是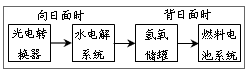
[? ]
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阴极反应:4OH-―4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
参考答案:BC
本题解析:
本题难度:一般
4、选择题 茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池.在这种电池中①铝合金是阳极?②铝合金是负极③海水是电解液?④铝合金电极发生还原反应,说法正确的是( )
A.②③
B.②④
C.①②
D.①④
参考答案:电池电极只称为正、负极,故①错;
其中活泼的一极为负极,即为铝合金,故②对;
电极在海水中,海水中含有大量的电解质,故③对;
铝合金为负极,则发生氧化反应,故④错;
故选A.
本题解析:
本题难度:简单
5、选择题 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是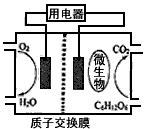
[? ]
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-==6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4/6? L
参考答案:B
本题解析:
本题难度:一般