时间:2020-07-07 22:59:32
1、选择题 下图是向25.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH变化的图象,根据图象分析,下列结论中不正确的是?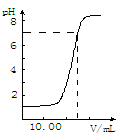
A.盐酸起始浓度为0.10 mol·L-1
B.NaOH溶液浓度为0.10 mol·L-1
C.滴到中点时,耗NaOH物质的量为0.0025mol
D.滴入碱量为20.00mL时,向混合溶液中滴入2滴酚酞试液,溶液显红色
参考答案:D
本题解析:D项:碱量为20.00mL时,溶液还呈酸性,故不显红色,故错。故选D。
点评:本题考查的是中和滴定时溶液的PH计算,指示剂的显色范围。难度中。注重对教材知识的学习。
本题难度:一般
2、选择题 用1.0 mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图3-5所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是(?)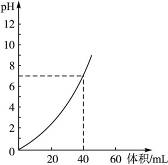
图3-5
A.1 mol·L-1,60 mL
B.0.5 mol·L-1,80 mL
C.0.5 mol·L-1,40 mL
D.1 mol·L-1,80 mL
参考答案:B
本题解析:pH=7时,V(NaOH)="40" mL ,n(NaOH)="0.04" mol,则n(H2SO4)="0.02" mol,只有B项符合。
本题难度:简单
3、选择题 国际石油价格多次上涨,为解决能源危机,现在全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。已知热化学方程式:1/2C2H5OH(l)+3/2O2(g) = CO2(g)+3/2H2O(l) △H=-683.4kJ/mol。下列有关说法正确的是 ( )
A.乙醇汽油是一种清洁能源,燃烧不会产生任何污染
B.在25℃、101KPa时,生成1mol水时放出683.4kJ的热量
C.乙醇的燃烧热为683.4kJ/mol
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
参考答案:D
本题解析:略
本题难度:一般
4、选择题 pH=6的HCl和NH4Cl溶液中,由水电离出的c(H+)分别为x mol/L、ymol/L,两者关系是
A.相等
B.x>y
C.x=10-2y
D.x=102y
参考答案:C
本题解析:在pH=6的HCl溶液中,水电离出的c(H+)=水电离出的c(OH—)=溶液中的c(OH—)=10-8mol/L
在pH=6的NH4Cl溶液中,溶液中的H+全部均来自于水的电离,所以由水电离出的c(H+)=10-6mol/L
所以x=10-2y,答案为C
本题难度:简单
5、实验题 (14分)(Ⅰ)FeCl3的水溶液呈________(填“酸性”、“碱性”或“中性”),原因是__________________________________(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以___________(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如右图所示,其读数为 ?mL。
(2)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
参考答案:(Ⅰ)(1)酸性;Fe3++3H2O Fe(OH)3+3H+;抑制;Fe2O3?
Fe(OH)3+3H+;抑制;Fe2O3?
(Ⅱ)(1)22.60?(2)0.1250?(3)A、B、C、D
本题解析:(Ⅰ)把FeCl3溶液蒸干,水解平衡正向移动,生成Fe(OH)3,再灼烧,Fe2O3分解生成Fe2O3;
(Ⅱ)(1)读数时注意滴定管的刻度特点:小刻度在上,大刻度在下,且读到0.01 mL;
(2)首先要计算两次所用盐酸体积的平均值:
V1=25.40-0.50=24.9mL? V2="29.10-4.00=25.10" mL
则所用盐酸体积的平均值=(24.9+25.10)/2="25.00" mL
由NaOH+HCl=NaCl+H2O,得:C(NaOH)V(NaOH)= C(HCl)V(HCl),则
C(NaOH)=(0.10mol/L×25.00 mL)/20.00 mL="0.1250" mol/L;
(3)利用关系式C(NaOH)= C(HCl)V(HCl)/ V(NaOH)判断,
在代入数据时,C(HCl)=0.10mol/L,V(NaOH)="20.00" mL,所以,所有的不当操作都归结为对盐酸体积的读数;且C(NaOH)与V(HCl)成正比;
锥形瓶用待测液润洗后再注入待测液,n(NaOH)增多,导致V(HCl)增大,故使实验结果偏高;
酸式滴定管未用标准液润洗,将导致C(HCl)减小,消耗V(HCl)增大,故使实验结果偏高;
C中V(HCl)=V2-V1,滴定后仰视读数,导致V2增大,滴定前俯视读数,导致V1减小,则导致V(HCl)增大,故使实验结果偏高;
D将导致V(HCl)增大(多出的盐酸体积=气泡体积),故使实验结果偏高;
本题难度:一般