时间:2020-07-07 22:57:07
1、填空题 (2分).写出下列物质的电离方程式
(1)H2CO3
(2)KNO3
参考答案:(1)H2CO3 . 2H++HCO3- (2)KNO3 =K++NO3-
. 2H++HCO3- (2)KNO3 =K++NO3-
本题解析: (1)碳酸是弱电解质,所以能部分电离出氢离子和碳酸氢根离子,故写成: H2CO3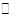 2H++HCO3
2H++HCO3
本题难度:一般
2、选择题 酸碱指示剂一般是有机弱酸(用Hln表示)或弱碱,其分子形式与电离出的ln-形式颜色不同,在pH值不同的溶液中之所以能表现出不同的颜色,是因为其电离平衡发生移动的结果.甲基橙是一种常用的酸碱指示剂,溶于水后发生如下电离:Hln?H++ln-,已知在pH<3.1的溶液中呈红色,在pH>4.4的溶液中呈黄色,下列判断中不正确的是( )
A.Hln呈红色
B.ln-呈黄色
C.遇pH值介于3.1~4.4的溶液可能呈橙色
D.Hln呈黄色
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列各项所述内容对应的图像不正确的是
[? ]
A.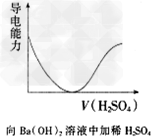
B.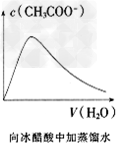
C.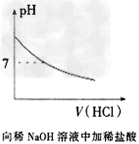
D.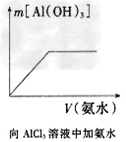
参考答案:C
本题解析:
本题难度:一般
4、简答题 I.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K=1.着5×10-5
碳酸K1=4.30×10-着K2=5.61×10-11
亚硫酸K1=1.54×10-2K2=1.02×10-着
(1)写出碳酸的第一级电离平衡常数表达式:K1=______.
(2)在相同条件下,试比较CH3COONa、Na2CO3和Na2SO3水溶液的碱性强弱:______>______>______.
(3)在相同条件下,试比较同浓度同体积H2SO3、NaHSO3和Na2SO3溶液中粒子的数目:______>______>______.
(4)若保持温度不变,在醋酸溶液中加入1量盐酸,下列量会变5的是______(填序号).
A.c(CH3COO-)B.c(H+)C.醋酸电离平衡常数D.醋酸的电离程度
II.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS KSP 8.3×10-1着 5.6×10-8 6.3×10-50 着.1×10-9 1.2×10-15 3.4×10-28 |
参考答案:(1)碳酸的第一级电离方程式为H2CO3?H++HCO3-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,则K1=c(H+)c(HCO-3)c(H2CO3),故答案为:c(H+)c(HCO-3)c(H2CO3);
(2)CH3COONa、Na2CO3和Na2SO3三种盐对应的酸为醋酸、HCO3-、HSO3-,由醋酸的电离平衡常数K>亚硫酸的K2>碳酸的K2,酸性越弱,盐中离子的水解就越大,则水解程度最小的为醋酸钠,水解程度最大的为碳酸钠,故答案为:Na2CO3;Na2SO3;CH3COONa;
(3)相同条件下,同浓度同体积H2SO3、NaHSO3和Na2SO3溶液中,三种物质的物质的量相同,只有亚硫酸为弱电解质,则粒子的数目最少,而NaHSO3和Na2SO3为强电解质,相同物质的量时亚硫酸钠中粒子的数目多,又NaHSO3和Na2SO3溶液中水解与电离的程度都很小,故答案为:Na2SO3;NaHSO3;H2SO3;
(4)因加入盐酸,醋酸的电离平衡逆向移动,则c(CH3COO-)减小,醋酸的电离程度减小,但温度不变,则醋酸电离平衡常数不变,加盐酸时c(H+)增大,故答案为:Aj;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;
(v)由表格中的溶度积数据可知,Ag2S和PsS的溶度积最小,则加入Na2S沉淀效果最好,故答案为:s;&nssp;&nssp;
(l)废水中NaCl的质量分数为0.117%(ρ≈1g?mL-1),c(Cl-)=c(NaCl)=1000×1g/mL×0.117%v8.vg/mol=0.02mol/L,
Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10mol2?L-2,
则c(Ag+)=1.8×10-100.02=下×10-下mol?L-1,故答案为:下×10-下mol?L-1.
本题解析:
本题难度:一般
5、选择题
A.107
B.5.56×108
C.1.0×10-14
D.55.6
参考答案:B
本题解析:常温下,c(H+)=1.0×10-7 mol·L-1,即每升水中已电离的水的物质的量是1.0×10-7 mol,而每升水的物质的量是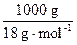 ,则:
,则:
n= mol∶10-7 mol=5.56×108
mol∶10-7 mol=5.56×108
本题难度:一般