时间:2020-07-07 22:55:41
1、填空题 (16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
参考答案:(1)4.4~7.5 (2分) Al3+ (2分)
(2)氧化Fe2+(2分) 2H+ + Fe2++ NO2- = Fe3+ + NO↑+ H2O (3分)
(3)2 mol (2分) (4)2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+ (3分) (5)D (2分)
Fe2(OH)42+ + 2H+ (3分) (5)D (2分)
本题解析:(1)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH使溶液中的Al3+生成Al(OH)3沉淀,同时要避免生成应Fe(OH)2沉淀,控制pH在4.4≤pH<7.5之间;
(2)亚硝酸盐具有氧化性,在酸性条件下能把亚铁离子氧化生成铁离子,反应的离子方程式为2H+ + Fe2++ NO2- =Fe3+ + NO↑+ H2O;
(3)氧气的物质的量是11.2L÷22.4L/mol=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2molNaNO2;
(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+;
Fe2(OH)42+ + 2H+;
(5)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合,答案选D。
考点:考查物质制备工艺流程图的有关判断与计算
本题难度:困难
2、实验题 (11分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: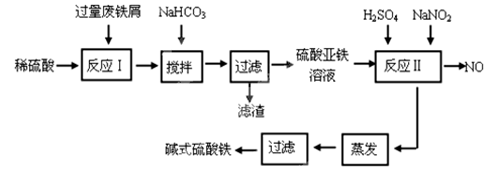
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
参考答案:(1)4.4 ~ 7.5; Al3+ (2)2H++Fe2++NO2-=Fe3++H2O+NO↑
(3)2mol (4)2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+ (5)D
本题解析:(1)由题意可知,过量废铁屑溶于稀硫酸得FeSO4、Al2(SO4)3混合溶液,根据表中数据可知,向混合溶液中加入少量NaHCO3,沉淀Al3+而不沉淀Fe2+,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;
(2)反应Ⅱ是亚硝酸钠氧化亚铁离子便于铁离子沉淀分离,离子方程式为2H++Fe2++NO2-=Fe3++H2O+NO↑;
(3)流程产物分析可知O2与NaNO2在反应中做氧化剂;n(O2)=11.2L÷22.4L/mol=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,因此相当于NaNO2的物质的量为 2mol;
(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+;
(5)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合;故选D。
考点:考查物质制备实验原理的设计
本题难度:困难
3、选择题 已知298K时,Ksp(CaCO3)= 2.80×10-9,Ksp(CaSO4)= 4.90×10-5。若用难溶盐在溶液中的物质的量浓度来表示其溶解度,则下面的叙述正确的是(? )
A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L
B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104
C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质
D.升高温度,两种盐的溶度积与溶解度都保持不变
参考答案:B
本题解析:固体的溶解度是g,A不正确;根据反应的方程式可知,该反应的平衡常数K=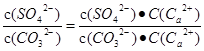 =Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104,B正确;CaCO3、CaSO4都是强电解质,与溶液的导电性强弱无关系,C不正确;升高温度,促进溶解,两种盐的溶度积与溶解度都增大,D不正确,答案选B。
=Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104,B正确;CaCO3、CaSO4都是强电解质,与溶液的导电性强弱无关系,C不正确;升高温度,促进溶解,两种盐的溶度积与溶解度都增大,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确溶解平衡的特点、溶度积常数的含义以及外界条件对溶解平衡和溶度积常数的影响,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率,激发学生的学习积极性。
本题难度:一般
4、选择题 已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列说法正确的是?
[? ]
A.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
参考答案:D
本题解析:
本题难度:一般
5、选择题 下表是三种银盐的溶度积常数KSP(25℃).下列说法不正确的是
A.25℃时.三种银盐的饱和溶液中,c(Ag+)最大的是AgCl溶液
B.在AgCl的悬浊液中加入0.1mol/L的KI溶液,可能有黄色沉淀产生
C.25℃时.AgC1固体在等物质的量浓度的NaC1、CaC12溶液中的溶度积相同
D.在AgBr的悬浊液中加入0.1mol/L的KI溶液.发生反应的离子方程式为I-+Ag+=AgI↓。
参考答案:D
本题解析:A. 由于三种盐的组成相同,所以离子积常数越大,在饱和溶液中的离子的浓度就越大。因为AgCl的溶度积常数最大,所以该盐的饱和溶液中,c(Ag+)最大。正确。B. 由于在AgCl的悬浊液中存在着沉淀溶解平衡AgC1(s) Ag+(aq)+Cl-(aq).当向溶液中加入KI溶液时,由于Ksp(AgI)< Ksp(AgCl),发生沉淀反应:I-+Ag+=AgI↓,破坏了AgC1的沉淀溶解平衡,AgCl继续溶解,又不断的被消耗,最终会有一部分AgCl白色沉淀转化为AgI黄色沉淀。正确。C.物质的溶度积常数只与物质的性质及温度有关,而与其它条件无关。由于温度相同,所以溶度积常数相同。正确。D. 在AgBr的悬浊液中存在着沉淀溶解平衡AgBr(s)
Ag+(aq)+Cl-(aq).当向溶液中加入KI溶液时,由于Ksp(AgI)< Ksp(AgCl),发生沉淀反应:I-+Ag+=AgI↓,破坏了AgC1的沉淀溶解平衡,AgCl继续溶解,又不断的被消耗,最终会有一部分AgCl白色沉淀转化为AgI黄色沉淀。正确。C.物质的溶度积常数只与物质的性质及温度有关,而与其它条件无关。由于温度相同,所以溶度积常数相同。正确。D. 在AgBr的悬浊液中存在着沉淀溶解平衡AgBr(s) Ag+(aq)+Br-(aq).当向溶液中加入KI溶液时,由于Ksp(AgI)< Ksp(AgBr),AgBr溶解电离产生的Ag+会发生沉淀反应:I-+Ag+=AgI↓,该反应的离子方程式为:I-+AgBr="AgI+" Br-。错误。
Ag+(aq)+Br-(aq).当向溶液中加入KI溶液时,由于Ksp(AgI)< Ksp(AgBr),AgBr溶解电离产生的Ag+会发生沉淀反应:I-+Ag+=AgI↓,该反应的离子方程式为:I-+AgBr="AgI+" Br-。错误。
本题难度:一般