时间:2020-07-07 22:55:21
1、填空题 Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。自然界中铁矿石主要有赤铁矿和磁铁矿。金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
①写出磁铁矿主要成分的化学式:?。
②写出赤铁矿还原成铁的化学方程式:?。
③写出焦炭在高炉中所参与反应的两个化学方程式:?。
④写出CaCO3所参与反应的两个化学方程式:?。
参考答案:①Fe3O4? ②Fe2O3+3CO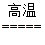 2Fe+3CO2或Fe2O3+3C
2Fe+3CO2或Fe2O3+3C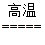 2Fe+3CO
2Fe+3CO
③C+O2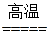 CO2? CO2+C
CO2? CO2+C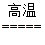 2CO
2CO
④CaCO3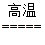 CaO+CO2↑? CaO+SiO2
CaO+CO2↑? CaO+SiO2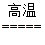 CaSiO3
CaSiO3
本题解析:本题主要考查炼铁的原料和炼铁高炉中发生的化学反应,解答要注意区分赤铁矿与磁铁矿所含主要成分的不同。我国是钢铁大国,高考题中出现“炼铁”知识点也是近年来“综合测试”特色。
本题难度:简单
2、填空题 (10分)向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)―→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段:?。
第二阶段:?。
(2)正确表达这两个阶段反应中,加入铁粉的物质的量与溶液中铁元素存在的形式的关系
?
?
?。
(3)在图中画出溶液中Fe2+、Fe3+、NO的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
参考答案:(1)Fe+4H++NO=Fe3++NO↑+2H2O? 2Fe3++Fe=3Fe2+
(2)①加入Fe粉为0~0.2 mol时,存在形式为Fe3+;
②加入铁粉为0.2~0.3 mol时,存在形式为Fe2+和Fe3+;
③加Fe粉为n(Fe)≥0.3 mol时,存在形式为Fe2+。
(3)如图: 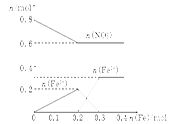
本题解析:(1)第一阶段的离子方程式为:Fe+4H++NO=Fe3++NO↑+2H2O。第二阶段加入的Fe会将生成的Fe3+还原成Fe2+,离子方程式为2Fe3++Fe=3Fe2+。
(2)第一阶段中0.8mol硝酸消耗铁粉0.2mol,产生Fe3+0.2mol,第二阶段消耗铁粉0.1mol,产生Fe2+0.3mol,所以当铁粉加入量大于0.2mol小于0.3mol时,既有Fe3+,又有Fe2+。
(3)此过程的图像为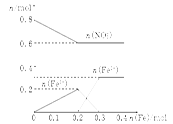
点评:本题难度较大,主要考查学生分析各个阶段Fe的存在方式。
本题难度:一般
3、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为(? )
A.0.24 mol
B.0.21 mol
C.0.16 mol
D.0.14 mol
参考答案:B
本题解析:120mL 4mol·L-1的稀硝酸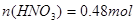 ;1.344L NO(标准状况)的物质的量为
;1.344L NO(标准状况)的物质的量为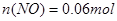 ,由于反应后铁以硝酸亚铁形式存在,由N元素守恒可得反应后生成的硝酸亚铁的物质的量为
,由于反应后铁以硝酸亚铁形式存在,由N元素守恒可得反应后生成的硝酸亚铁的物质的量为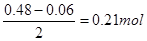 ,即原Fe、FeO和Fe2O3的混合物中铁元素的物质的量为0.21mol;
,即原Fe、FeO和Fe2O3的混合物中铁元素的物质的量为0.21mol;
本题难度:一般
4、选择题 20°C时有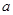 g硫酸铜溶液
g硫酸铜溶液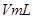 ,将溶液蒸发掉
,将溶液蒸发掉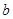 g水后恢复到20°C,恰好全部生成硫酸铜晶体
g水后恢复到20°C,恰好全部生成硫酸铜晶体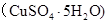 ,则下列关系式错误的是
,则下列关系式错误的是
A.原硫酸铜溶液的密度为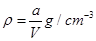
B.原硫酸铜溶液的物质的量浓度为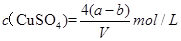
C.原硫酸铜溶液的溶质质量分数为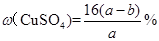
D.生成硫酸铜晶体的物质的量为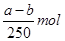
参考答案:C
本题解析:A正确,根据关系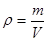 或知,原硫酸铜溶液的密度为
或知,原硫酸铜溶液的密度为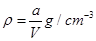
B正确,原溶液中硫酸铜的物质的量量=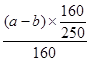 =
=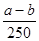 mol,所以原溶液的浓度可得为
mol,所以原溶液的浓度可得为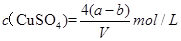
C错,原硫酸铜溶液的溶质质量分数=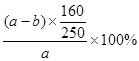
D正确,由铜元素守恒可得:生成硫酸铜晶体的物质的量为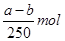
本题难度:一般
5、填空题 (11分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物,C的焰色反应为黄色,M为红褐色固体。
(1)写出: J的结构式 ?,M的化学式?;
?,M的化学式?;
(2)基于反应①原理的化学工业称为?;写出该反应的化学方程式?;
(3)写出K溶液和E反应的离子方程式?;写出F溶液和H反应的离子方程式?;
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为?
参考答案:
本题解析:略
本题难度:一般