时间:2020-07-07 22:51:31
1、计算题 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图。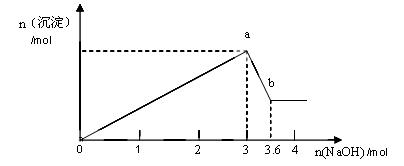
(1)a点对应的沉淀为?(填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少?(写出计算过程)
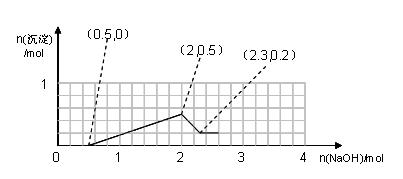
(3)若取原混合溶液50mL,并加入0.5mol盐酸组成新的混合溶液。往新的混合溶液中逐滴加入NaOH溶液,请在坐标内画出生成沉淀的物质的量随加入的NaOH的物质的量的关系图(在答题卷上作图)。
参考答案:(1)Fe(OH)3、Al(OH)3(1分)
(2)4mol/L。
(3)
本题解析:略
本题难度:简单
2、填空题 某化合物M(式量为80)俗称黑肥宝,它由原子序数不大于20的X、Y、Z三种元素组成,X、Y、Z的原子序数依次增大,其关系为Z=X+2Y。X、Y是同周期相邻的两种元素。M微溶于水,在常温下与水作用发生缓慢水解,最终产物为一种白色沉淀A与气体B,该气体能使湿润的红色石蕊试纸变蓝,A在高温条件下可分解产生一种有温室效应的气体。(注:以下回答若涉及到具体物质均用相应的化学式或元素符号表示)
(1)化合物M的化学式为??;Z的原子结构示意图为??。
(2)写出下列反应的化学方程式。A在高温下分解:??; ?M与水反应生成A和B:?。
(3)Z的氢化物可作为一种储氢材料,写出其与水反应的化学方程式 ??。
(4)储氢材料的研究很广泛。下列物质中,可作为储氢材料的是???。(填编号)
A.Ca(OH)2
B.MgH2
C.O2
D.LaNi5
(5)物质B有如下转化关系: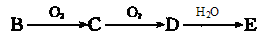 (强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子?。
(强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子?。
参考答案:(1)CaCN2?
(2)CaCO3 CaO+CO2↑? CaCN2+3H2O=CaCO3+2NH3↑
CaO+CO2↑? CaCN2+3H2O=CaCO3+2NH3↑
(3)CaH2+2H2O=Ca(OH)2+2H2↑?(4)B D
(5)取一定量的溶液,滴加AgNO3溶液产生白色沉淀,该沉淀能溶于稀硝酸,说明原溶液中的阴离子是NO2-。
本题解析:(1)M微溶于水,在常温下与水作用发生缓慢水解,最终产物为一种白色沉淀A与气体B,该气体能使湿润的红色石蕊试纸变蓝,则B为NH3;白色沉淀A在高温条件下可分解产生一种有温室效应的气体——CO2,则A为CaCO3。根据质量守恒定律可得M为CaCN2。则这三种元素分别是X为C,Y为N,Z为Ca。它与水发生反应的方程式为CaCN2+3H2O=CaCO3+2NH3↑。Ca的原子结构示意图为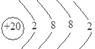 。(2)CaCO3分解的化学反应方程式为:CaCO3
。(2)CaCO3分解的化学反应方程式为:CaCO3 CaO+CO2↑;CaCN2与水发生反应的方程式为:CaCN2+3H2O=CaCO3+2NH3↑。(3)Z的氢化物CaH2其与水反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑。(4)储氢材料是一类能可逆地吸收和释放氢气的材料。A. Ca(OH)2没有可逆地吸收和释放氢气的作用。错误。B. MgH2有可逆地吸收和释放氢气的作用。金属氢化物储氢特点是反应可逆。氢以原子形式储存,固态储氢,安全可靠较高的储氢体积密度。正确。C.O2不能吸收氢气和储存氢气。错误。D. 具有储氢的功能。稀土镧镍系储氢合金典型代表是LaNi5,其特点是活化容易,平衡压力适中且平坦,吸放氢平衡压差小抗杂质气体中毒性能好适合室温操作。正确。(5)由题图可知:B为NH3,C为NO;D为NO2;E为HNO3。将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐。反应的方程式为NO+NO2+2NaOH=2NaNO2+H2O。NO2-的检验方法为取一定量的溶液,滴加AgNO3溶液产生白色沉淀,该沉淀能溶于稀硝酸,说明原溶液中的阴离子是NO2-。
CaO+CO2↑;CaCN2与水发生反应的方程式为:CaCN2+3H2O=CaCO3+2NH3↑。(3)Z的氢化物CaH2其与水反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑。(4)储氢材料是一类能可逆地吸收和释放氢气的材料。A. Ca(OH)2没有可逆地吸收和释放氢气的作用。错误。B. MgH2有可逆地吸收和释放氢气的作用。金属氢化物储氢特点是反应可逆。氢以原子形式储存,固态储氢,安全可靠较高的储氢体积密度。正确。C.O2不能吸收氢气和储存氢气。错误。D. 具有储氢的功能。稀土镧镍系储氢合金典型代表是LaNi5,其特点是活化容易,平衡压力适中且平坦,吸放氢平衡压差小抗杂质气体中毒性能好适合室温操作。正确。(5)由题图可知:B为NH3,C为NO;D为NO2;E为HNO3。将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐。反应的方程式为NO+NO2+2NaOH=2NaNO2+H2O。NO2-的检验方法为取一定量的溶液,滴加AgNO3溶液产生白色沉淀,该沉淀能溶于稀硝酸,说明原溶液中的阴离子是NO2-。
本题难度:一般
3、选择题 有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。E的溶质是一种无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是(?)
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
参考答案:A
本题解析:由题干表述可知A和E不是盐,又由E为无色油状液体,推知E为浓硫酸(③步操作进一步确定);由题干和①步操作可知A为氨水;再由②步操作可知F中阳离子为Ag+,发生的反应为Ag++NH3·H2O=AgOH↓+NH4+,AgOH+2NH3·H2O=[Ag(NH3)2]+OH-+2H2O,而常见的银盐中只有AgNO3可溶于水,故F为AgNO3;由③步操作可知盐B与E(H2SO4)放出的无色无味的气体只能是CO2,所以B中阴离子应为CO32-或HCO3-,C、D、F生成沉淀说明应该是CO32-,而阳离子可以是常见的K+、Na+、NH4+等待定;同样由②步操作知,能与氨水生成沉淀的无色溶液中常见的阳离子为Mg2+或Al3+,由于题中只说B(含CO32-)与D生成沉淀,并没指出有无气体,所以D可能含Mg2+,也可能含Al3+,D的阴离子在此处不能确定;由④步知C与D、E(H2SO4)、F(AgNO3)生成不溶于HNO3的沉淀,所以C必为BaCl2;进而推出D中阴离子应该为SO42-,故D为Al2(SO4)3或MgSO4。
点拨:本题考查物质的推断,考查考生对元素化合物知识的理解能力。难度较大。
本题难度:一般
4、选择题 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则
[? ]
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
参考答案:AD
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.CuSO4?5H2O放置于空气中,由蓝色晶体变为无色粉末,发生物理变化
B.1869年俄国化学家门捷列夫发现元素周期律,标志着近代化学的诞生
C.84消毒液、KMnO4、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.汽车尾气含有少量氮的氧化物,既能造成光化学烟雾,也能造成酸雨。
参考答案:D
本题解析:A、CuSO4?5H2O蓝色晶体变为无色粉末,发生了CuSO4?5H2O= CuSO4+5H2O,为化学反应,错误;B、英国科学家波义耳提出化学元素的概念,标志着近代化学的诞生,错误;C、酒精消毒不是利用强氧化性,其原理是酒精能使蛋白质变性,错误;D、氮的氧化物与碳氢化合物在紫外线照射下形成光化学烟雾,氮的氧化物与氧气、水反应最终转化为HNO3,能形成酸雨,正确。
本题难度:一般