时间:2019-07-04 02:15:37
1、简答题 有X、Y、Z、W四种短周期元素,原子序数依次增大.其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的3/4;W元素原子最外层比同周期Z元素多5个电子,W和Y不属于同一主族.
(1)写出元素符号:X______,Y______,Z______.
(2)W元素最高价氧化物对应的水化物的化学式是______.
(3)X、Y两种元素形成的化合物的化学式有______.
参考答案:X、Y、Z、W四种短周期元素,原子序数依次增大,由Y元素原子最外层电子数占核外总电子数的34,最外层电子数不超过8,故核外电子总数小于11,且为4的倍数,核外总电子为8符合,则最外层电子数为6,即Y为氧元素;W和Y不属于同一主族,W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子,则W处于ⅦA族,Z处于ⅡA族,Z原子序数大于氧元素,则W、Z处于第三周期,故W为氯,Z为镁;四元素核电荷数总和为38,X的核电荷数为38-8-12-17=1,则X为氢元素,
(1)由上述分析可知,X为H、Y为O、Z为Mg,故答案为:H;O;Mg;
(2)W为氯,其最高价氧化物对应的水化物的化学式是HClO4,故答案为:HClO4;
(3)H、O两种元素形成的化合物的化学式有H2O、H2O2,故答案为:H2O、H2O2.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.H216O、D216O、H218O、D218O互为同素异形体
B.有单质生成的反应一定是氧化还原反应
C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF
D.电子层结构相同的不同离子,其半径随核电荷数的增大而减小
参考答案:D
本题解析:A.四者均为水分子,只不过原子核内的中子数略有不同,而同素异形体是指同种元素的不同单质,错误
B.同素异形体之间的置换(O2=O3),虽然有单质生成,但并无化合价的改变,并非氧化还原反应,错误
C.由于HF分子之间存在氢键,使其沸点反常的高,错误
D.正确,故答案为D
本题难度:一般
3、选择题 下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的氧原子的核素符号:

参考答案:A
本题解析:
本题难度:一般
4、选择题 下列物质中,只含有非极性共价键的是
[? ]
A.NaOH
B.NaCl
C.H2
D.H2S
参考答案:C
本题解析:
本题难度:简单
5、填空题 下面是C60、金刚石和二氧化碳的分子模型。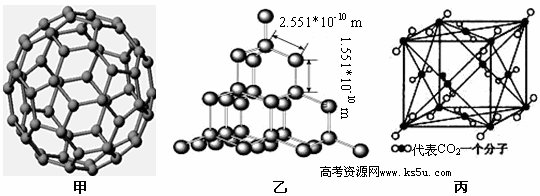
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________;晶体硅中硅原子与共价键的个数比为?
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中 键与
键与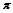 键的个数比为?。
键的个数比为?。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______,丙烯分子中2号碳原子的杂化方式是_______,丙烯分子中最多有?个原子共平面。
参考答案:(1)1s22s22p63s23p2?(2)分子 (3)6?;1:2?(4)4?;1:1(5)sp3?;sp2?;7
本题解析:(1)硅的原子数序为14,基态时的核外电子排布式为1s22s22p63s23p2;(2)由题给结构模型知,C60有固定的组成,不属于空间网状结构,为分子晶体;(3)由题给结构模型知,金刚石中的最小环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,硅晶体结构中每个硅与硅的化学键之间插入一个O原子,则Si、O原子形成的最小环上O原子的数目是6,二氧化硅晶体中,每个Si原子与4个O原子形成共价键,每一个共价键中Si的贡献为一半,则平均1个Si原子形成2个共价键,所以晶体硅中硅原子与共价键的个数比为1:2;(4)二氧化碳的晶胞中,二氧化碳分子位于晶胞的顶点和面心位置,则晶胞中含有二氧化碳的分子数为8×1/8+6×1/2=4,二氧化碳的分子结构为O=C=C,每个分子中含有2个σ键和2个π键,所以σ键与π键的个数比为1:1;(5)根据丙烷和丙烯的结构分析,丙烷分子中2号碳原子形成4个σ键,所以杂化方式是sp3,丙烯分子中2号碳原子碳原子形成3个σ键,所以杂化方式是sp2,丙烯中含有乙烯的结构特点,和双键共平面的原子共有6个原子,甲基中含C-H键,原子围绕着σ键旋转,则最多有1个原子和其它6个原子共平面,即丙烯分子中最多有7个原子共平面。
本题难度:一般