时间:2019-07-04 02:14:36
1、选择题 在一定条件下,KClO3与I2发生下列反应:2KClO3+I2=2KIO3+Cl2推断正确的是
A.该反应属于置换反应
B.氧化性I2>KClO3
C.还原性KClO3>I2
D.还原剂为I2,氧化剂为KClO3
参考答案:D
本题解析:
本题难度:简单
2、选择题 将Cu片放入0.1mol·L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c (Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
[? ]
A.3:2
B.3:5
C.3:4
D.4:3
参考答案:C
本题解析:
本题难度:简单
3、选择题 氧化还原反应的本质是
A.反应中原子重新组合
B.得氧、失氧
C.化合价升降
D.电子的得失或偏移
参考答案:D
本题解析:分析:氧化还原反应的实质为电子的得失或偏移,与其它因素无关.
解答:A.化学反应的实质为原子重新组合,但不一定为氧化还原反应,故A错误;
B.氧化还原反应中不一定有氧元素参加反应,故B错误;
C.化合价的升降为氧化还原反应的特征,故C错误;
D.氧化还原反应的实质为电子的得失或偏移,故D正确.
故选D.
点评:本题考查氧化还原反应,题目难度不大,注意把握氧化还原反应的特征和实质.
本题难度:一般
4、选择题 一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01mol/L的NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为
[? ]
A.2:3
B.1:3
C.1:4
D.5:3
参考答案:C
本题解析:
本题难度:一般
5、填空题 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2?= KOCN+2KCl+H2O 被氧化的元素是 __________ 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请标出电子转移方向和数目:
2KOCN +4KOH +3Cl2 =2CO2+ N2 +6KCl+2H2O。
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯_________g。
参考答案:(1)碳或(C) (2)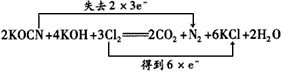 (3)35.5
(3)35.5
本题解析:
本题难度:一般