时间:2019-07-04 02:12:47
1、填空题 钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: __________________________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3·xH2O),反应的化学方程式是: ______________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是:____________________________。
(4)下列哪个装置可防止铁棒被腐蚀____________。 
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下
请回答:
①A电极对应的金属是_______(写元素名称),B电极的电极反应式是:____________。
②若电镀前铁、铜两极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12?g,则电镀时电路中通过的电子为____________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因____________________________________________。
参考答案:(1)3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(2)4Fe+3O2+2xH2O=2Fe2O3·xH2O
(3)2FeCl3+Fe=3FeCl2
(4)BD
(5)①铜;Cu2++2e-=Cu;②0.08;③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
本题解析:
本题难度:一般
2、填空题 (16分)如右图所示,A、B、C三个装置中的三个烧杯分别盛有足量的CuCl2溶液。 
A(左Zn右Cu) B(左C右Pt) C(左Zn右Cu)
(1)、A、B、C三个装置中属于原电池的是_____ (填标号,下同),属于电解池的是___ _________。
(2)、A池中Zn是_______极,发生_______反应(填“氧化”或“还原”,下同),电极反应式为_________; Cu是_____极, 发生_____反应, 电极反应式为 ,A中总反应的化学方程式为 。
(3)、B池中C是_____极,发生_____反应,电极反应为 ;Pt是_____极,发生______反应,电极反应为 。B池中总反应的化学方程式为 ________________。
(4) C池中Zn是_____极,发生______反应,电极反应为_______________;Cu是 极, 发生 反应, 电极反应为 反应过程中,溶液浓度________(填“变大”“变小”或“不变”)。
参考答案:(1)A; B、C;
(2)负,氧化,Zn-2e-=Zn2+;正,还原,Cu2++2e-=Cu; Zn+CuCl2=Cu+ Zn Cl2;
(3)阴,还原,Cu2++2e-=Cu;阳,氧化,2Cl--2e-=Cl2↑; CuCl2 Cu+Cl2↑;
(4)阴,还原,Cu2++2e-=Cu;阳,氧化,Cu-2e-=Cu2+;不变;
本题解析:略
本题难度:一般
3、选择题 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O
参考答案:
本题解析:
本题难度:一般
4、填空题 如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_______________________________;
②乙中总反应的离子方程式为____________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了I-生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为_____________________________;
②如果起始时乙中盛有200?mL?pH=5的CuSO4溶液(25?℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入__________(填写物质的化学式)________g。
参考答案:(1)①O2+2H2O+4e-===4OH-;②2Cl-+2H2O 2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O===10H Cl+2HIO3
2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O===10H Cl+2HIO3
(2)①Fe-2e-=Fe2+;②CuO(或CuCO3);0.8(或1.24)
本题解析:
本题难度:一般
5、填空题 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: 溶液、
溶液、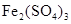 溶液、盐酸。按要求回答下列问题:
溶液、盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池
,若能,请写出电极反应式,负极 ,正极 。(若不能,后两空不填)
(3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池的正负极)
参考答案:(1) 略(2) 能 (负极)

(正极)
(3)(电极材料、电池的正负、闭合电路)
本题解析:(1)铜铝的电位不同,铜铝接触的部分会由于原电池反应加速铝线的氧化,时间久了铜铝接头处会接触不良;铝和铜相比,铝比较活泼,两种电缆连接,会加速铝氧化(也就是生锈),影响使用;在铜线和铝线连接处所生成的灰白色物质系三氧化二铝,时间稍长,连接处接触电阻会增大、发热,造成电路时通时断极易引发建筑物火灾。
(2)有导电性质不同的两极及电解质溶液,故能构成原电池。原电池的正极发生还原反应,负极发生氧化反应。
考点:原电池原理
点评:此题考核了有关原电池的原理,答题要求联系实际,结合原电池构成的三大要素电极材料、电池的正负、闭合电路,难度不大。
本题难度:一般