时间:2019-07-04 02:12:04
1、选择题 化学与生产、生活、科技等密切相关。下列说法正确的是
A.煤经气化和液化两个物理变化过程,可变为清洁能源
B.国务院要求坚决控制钢铁水泥焦炭等行业产能总量是落实“低碳经济”的具体举措
C.苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理
D.“神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃
参考答案:B
本题解析:煤的气化和液化都是化学变化,A不正确;苯酚有毒,自来水不能用苯酚消毒,C不正确;聚四氟乙烯属于是高分子化合物,不存在碳碳双键,D不正确,答案选B。
点评:该题是基础性试题的考查,试题注重基础,难度不大。该类试题常把化学知识与实际生产、生活、环境保护及科技前沿等问题结合起来,突出化学与可持续发展、环境保护的密切联系,综合考查学生分析问题、解决问题的能力。
本题难度:一般
2、填空题 (12分)、高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:①? 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
②? 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③? 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
⑴该生产工艺应在?__?(填“温度较高”或“温度较低”)的情况下进行;
⑵写出工业上制取Cl2的化学方程式?__?;
⑶配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为?__?;
⑷在“反应液I”中加KOH固体的目的是?__?:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
⑸从“反应液II”中分离出K2FeO4后,会有副产品?_?(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途?_?。
参考答案:(1)温度较低(2分)
(2)2NaCl + 2H2O  ?2NaOH + H2↑ + Cl2↑(2分)
?2NaOH + H2↑ + Cl2↑(2分)
(3)10 mol/L(2分)(4)AC(2分)
(5)KNO3? KCl(2分),? KNO3可用于化肥,炸药等(合理就给分)(2分)
本题解析:⑴根据工艺流程图,反应液I除去KCl主要是KClO溶液,氯气在较低温度下和KOH反应才得到KClO,所以,应在较低温度下进行。
⑵工业上制取Cl2是电解饱和的食盐水,化学方程式:2NaCl + 2H2O  ?2NaOH + H2↑ + Cl2↑
?2NaOH + H2↑ + Cl2↑
⑶所配KOH溶液的物质的量浓度为:n(KOH )="61.6" /56="1.1mol" 溶液体积V=(100+61.6)/1.47=110ml? C(KOH)=" 1.1mol/0.11L=10" mol/L
⑷在“反应液I”中加KOH固体的目的是:除去“反应液I”中过量的Cl2;为下一步反应提供反应物,所以选AC
⑸从“反应液II”中分离出K2FeO4后,根据元素守恒,会有副产品KNO3、 KCl,其中KNO3的主要用途是制化肥、制炸药等。
本题难度:一般
3、选择题 下列有关硫铁矿制硫酸的说法中,正确的是( )。
A.沸腾炉中出来的炉气,可直接进入转化器中进行催化氧化
B.焙烧硫铁矿的反应中,二氧化硫是唯一的氧化产物
C.生产过程中要采用高温高压,以有利于二氧化硫更好地转化为三氧化硫
D.三氧化硫在吸收塔中被吸收时,通常用质量分数为98.3%的硫酸做吸收剂,而不直接用水吸收
参考答案:D
本题解析:考查硫酸的生产工艺流程原理。沸腾炉中出来的炉气除了含有SO2、O2、N2外还有水蒸气及其他杂质,水蒸气和杂质对设备和下一步进行的氧化反应有害,因此必须进行净化和干燥处理,故A错误。FeS2被氧化,氧化产物为SO2和Fe2O3,故B错误。高温对反应速率有利,但对转化率不利;高压虽然对二者皆有利,但实践证明常压下二氧化硫转化率已经很高,故C错误。用质量分数98.3%的硫酸做吸收剂,可以防止形成酸雾提高三氧化硫的吸收率,故D正确。
本题难度:简单
4、填空题 工业上合成氨的主要生产过程有:
(1)原料气的制备、净气和压缩。氮气来源于________,氢气来源于________,净化原料气的原因是__________________________________________________________。
(2)氨的合成。在________中进行,反应的最佳条件是_______________________________________________________________。
(3)氨的分离。如将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中通常含体积分数为15%左右的氨气,则出来的混合气体中含H2的体积分数为________,N2的体积分数为________。
参考答案:(1)空气 水和碳氢化合物 防止催化剂中毒
(2)合成塔 压强20~50 MPa,温度400~500 ℃,铁触媒作催化剂
(3)63.75% 21.25%
本题解析:(3)设起始N2、H2的体积分别为1、3,反应中转化的N2的体积为x,则
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始体积 1 3 0
平衡体积 1-x 3-3x ? 2x
依题意: ×100%=15%
×100%=15%
解得:x=
故φ(H2)=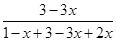 ×100%=63.75%
×100%=63.75%
φ(N2)=1-φ(H2)-φ(NH3)=21.25%
本题难度:简单
5、填空题 工业三废(废水、废气、废渣)处理或将三废消灭于生产过程中,是近年来化工技术发展的方向之一。
(1)工业生产H2SO4的尾气中常含有少量SO2,通常用_________ 吸收,有关的化学方程式为________________________;然后再用硫酸处理,目的是______________。硫酸厂的废水呈____性,通常加入____进行处理。
(2)铬的毒性与其存在的价态有关,六价铬比三价铬毒性高100倍,并易被人体吸收且能在体内蓄积。因此在处理含铬污水时,通常加入_________使六价铬转化为三价铬,再加__________使其转化为沉淀。
(3)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著 的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物,ClO2有下列两种制备方法。
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O。
用方法____制备的ClO2更适合用于饮用水消毒,其主要原因是________________________。
(4)对于含有Hg2+、Pb2+、Cu2+等重金属离子的工业废水,通常加入过量的_____________使其转化为沉淀而除去。
参考答案:(1)Ca(OH)2溶液;Ca(OH)2+SO2=CaSO3↓+H2O;将CaSO3转化为SO2,提高SO2的利用率,同时得到副产品CaSO4;酸;熟石灰
(2)FeSO4;碱
(3)二;方法二制得的ClO2中不含有Cl2
(4)Na2S
本题解析:
本题难度:一般