时间:2019-07-04 02:09:29
1、选择题 0.1 mol·L-1的下列物质的水溶液,只存在一种分子的是( )
A.NaF
B.NH4Cl
C.HClO
D.HNO3
参考答案:D
本题解析:NaF是强碱弱酸盐,水解显碱性,溶液中有H2O和HF两种分子。NH4Cl是强酸弱碱盐,水解显酸性,溶液中有H2O和NH3·H2O两种分子。HClO是弱酸,存在电离平衡,溶液中有H2O和HClO两种分子。硝酸是强酸,在溶液中全部电离,只有水分子。所以答案选D。
本题难度:一般
2、填空题 今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:(在空白处填上相应的字母)
A.①>②>③B.①<②<③C.①=②=③D.①=③>②
E.①>②=③F.①<②=③G.①=②<③H.①=②>③
(1)当它们的c(H+)相同时,其物质的量浓度关系是______.
(2)当它们的物质的量浓度相同时,其溶液中c(H+)的关系是______.
(3)中和等体积、等物质的量浓度的烧碱溶液,需等物质的量浓度的三种酸溶液的体积关系为______.
(4)当它们溶液中c(H+)相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______.
(5)当它们溶液中c(H+)相同、体积相同时,同时加入锌,则开始时反应速率______,若产生相同体积的气体(相同状况),所需时间______.
(6)将溶液中c(H+)相同的三种酸均稀释10倍后,溶液中c(H+)关系为______.
参考答案:(1)当溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L,需要盐酸溶液浓度为1mol/L,H2SO4 溶液浓度为0.5mol/L,所以其物质的量浓度由大到小排列的是:①>②>③,
故选A;
(2)当它们的物质的量浓度相同时,假设浓度都是1mol/L,CH3COOH溶液电离出氢离子浓度小于1mol/L,HCl电离出氢离子浓度为1mol/L,H2SO4电离出的氢离子浓度为2mol/L,所以氢离子浓度大小顺序是:①<②<③,故选B;
(3)中和等量的烧碱溶液,假设氢氧化钠物质的量为1mol,需要①醋酸1mol,需要②HCl1mol,需要③H2SO40.5mol,所以需同浓度的三种酸溶液的体积大小关系为①=②>③,故选H;
(4)当它们溶液中c(H+)相同、体积相同时,分别加入足量锌,氢元素的物质的量越多,生成氢气则越多,所以醋酸生成氢气最多,盐酸和硫酸生成氢气相同,所以气体体积大小顺序是:①>②=③,故选E;
(5)当它们溶液中c(H+)相同、体积相同时,同时加入锌,反应速率与氢离子浓度成正比,开始时氢离子浓度相同,反应速率相同,故选C;
反应过程中,硫酸和盐酸中氢离子浓度逐渐减小,反应速率逐渐减小,随着反应的进行,醋酸电离出氢离子补充反应的氢离子,所以反应过程中醋酸中氢离子浓度大于硫酸和盐酸,醋酸反应速率快,生成相同体积的氢气所需时间最短,硫酸和盐酸生成相同体积所需氢气时间相同,故选F;
(6)将溶液中c(H+)相同的三种酸均稀释10倍后,醋酸中存在电离平衡,所以加水稀释促进醋酸电离,硫酸和氯化氢都是强电解质,加水稀释改变氢离子个数,所以氢离子浓度相等,醋酸中氢离子浓度最大,则氢离子浓度大小顺序是①>②=③,故选E.
本题解析:
本题难度:一般
3、选择题 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
 2H++S
2H++S参考答案:C
本题解析:从H2SO4的Ka可以看出,强酸在冰醋酸中电离受到抑制,多元酸分步电离,并非完全电离。
本题难度:一般
4、选择题 在25℃时,将a mol/L的醋酸溶液与0.01mol/L氢氧化钠溶液等体积混合,充分反应后溶液呈中性。下列说法不正确的是?(?)
A.a一定大于0.01
B.反应后溶液中一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.反应后溶液中一定有c(CH3COO-)+c(CH3COOH)>c(Na+)
D.反应后溶液中一定有c(Na+)>c(CH3COO-)>c(H+)=c(OH)
参考答案:D
本题解析:溶液呈中性,c(H+)=c(OH-),溶液中阳离子带的正电荷总数等于阴离子带的负电荷总数,所以c(Na+)=c(CH3COO-)?故 D错
本题难度:简单
5、选择题 已知下列弱酸的电离常数:
H2CO3: Ka1=4.30×10-7?;Ka2=5.61×10-11?
H2SO3: Ka1=1.54×10-2;Ka2=1.02×10-7
HClO:Ka=2.95×10-8?
下列离子在溶液中结合H+的能力不正确的是
A.HCO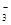 >HSO3-
>HSO3-
B.CO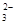 >SO
>SO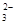
C.HCO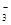 >ClO-
>ClO-
D.ClO->SO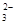
参考答案:C
本题解析:根据弱酸的电离常数判断,酸性越强,其酸根离子结合H+的能力越弱。A、酸性:H2SO3> H2CO3,所以结合H+的能力HCO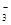 >HSO3-,正确;B、根据H2CO3:Ka2=5.61×10-11 H2SO3: Ka2=1.02×10-7判断酸性:HSO3-> HCO
>HSO3-,正确;B、根据H2CO3:Ka2=5.61×10-11 H2SO3: Ka2=1.02×10-7判断酸性:HSO3-> HCO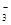 ,所以结合H+的能力CO
,所以结合H+的能力CO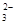 >SO
>SO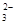 ,正确;C、酸性:H2CO3>HClO,所以结合H+的能力ClO-> HCO
,正确;C、酸性:H2CO3>HClO,所以结合H+的能力ClO-> HCO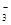 ,错误;D、酸性:HSO3->HClO,所以结合H+的能力ClO->SO
,错误;D、酸性:HSO3->HClO,所以结合H+的能力ClO->SO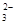 ,正确,答案选C。
,正确,答案选C。
本题难度:一般