时间:2019-07-04 02:06:59
1、选择题 下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O
B.将10mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中,c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+)
D.将10mL 0.1 mol.L-1 KAl(SO4)2溶液和10 mL 0.2 mol.L-1 Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
2、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。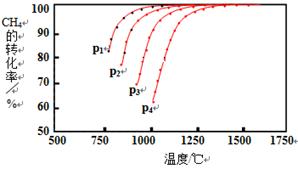
则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。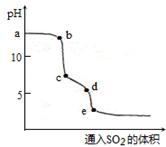
①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
3、选择题 已知:相同温度下Ka(HF)﹥Ka(HCN)。现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是
A.溶液pH:NaF﹥NaCN
B.n1 ﹥ n2
C.n1﹤ n2
D.c(F-)﹤c(CN-)
4、选择题 下列说法中不正确的是
A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<O,则该反应能自发进行
B.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3d.NaOH,则四种溶液中溶质的物质的量浓度由小到大顺序为:d<b<c<a
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液中水的电离程度相同
5、选择题 将下列溶液蒸干、并灼热后,仍能得到原溶质固体的是
A.AlCl3溶液
B.NaAlO2溶液
C.NaHCO3溶液
D.FeSO4溶液