时间:2019-07-04 01:54:53
1、选择题 已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是
[? ]
A.26.0kJ
B.51.9kJ
C.155.8kJ
D.467.3kJ
参考答案:A
本题解析:
本题难度:简单
2、填空题 联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57. 20 kJ/mol。一定温度下,在密闭容器中反应 达到平衡。
达到平衡。
其他条件不变时,下列措施能提高NO2转化率的是_____________ (填字母)。
A.减小NO2的浓度 B.降低温度? C.增加NO2的浓度 D.升高温度
(2)25℃时,1 00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(1)+N2O4(1)=3N2(g) +4H2O(1)的△H=____kJ/mol
(3)17℃、1.01×l05Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2) =0. 030 0 mol/L、c(N2O4)=0.0120 mol/L。计算反应 的平衡常数K。_______________________
的平衡常数K。_______________________
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?________________________________________
参考答案:(1)BC
(2) -1224.96
(3)根据题意知平衡时:c(N2O4)=0.012 0 mol/L c( NO2)=0.030 0 moI/L
答:平衡常数为13.3。
(4)由(3)可知,在17℃、1. 01×105 Pa达到平衡时,l.00 L 混合气体中:
n(N2O4)=c(N2O4)×V=0.0120 mol/L ×l.00L=0.0120 mol
n( NO2)=c( NO2)×v=0.0300 mol/L×l.00 L =0.0300 moI
则n总( NO2)=n(NO2) +2×n(N2O4)=0.0540 mol
由Cu+4HNO3=Cu(NO3)2+2NO2↑ +2H2O可得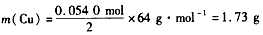
答:理论上至少需消耗Cu l.73 g。
本题解析:
本题难度:困难
3、选择题 使18?g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+1/2O2(g)===CO(g) ΔH1=-Q1?kJ/mol
CO(g)+1/2O2(g)===CO2(g) ΔH2=-Q2?kJ/mol
与完全燃烧相比较,损失的热量是
[? ]
A.1/2Q2?kJ?
B.1/3Q2?kJ
C.1/3(Q1+Q2)?kJ?
D.1/3Q1?kJ
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是
A.升高温度只能加快吸热反应速率
B.对于任何反应,增大压强都可加快反应速率
C.用正催化剂只能加快正反应速率
D.使用催化剂可同时改变正逆反应速率
参考答案:D
本题解析:考查外界条件对反应速率的影响。升高温度正逆反应速率都是增大的,选项A不正确;有气体参加或生成的反应,改变压强,反应速率才有可能改变,所以选项B不正确;催化剂是同等程度改变正逆反应速率,选项C不正确,所以正确的答案选D。
本题难度:一般
5、选择题 在一定条件下,CO和CH4燃烧的热化学方程式为:CO(g)+1/2O2=CO2(g);△H = -283KJ/mol
CH4(g)+ 2O2=CO2(g) +2H2O(g) ;△H = -890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953KJ,则CO和CH4的体积比
[? ]
A.1:3
B.3:1
C.1:2
D.2:1
参考答案:A
本题解析:
本题难度:一般