时间:2019-07-04 01:52:37
1、选择题 下列热化学方程式中的△H能表示可燃物的燃烧热的是
[? ]
A.H2(g)+ Cl2(g)=2HCl(g) △H=-184KJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3J·mol-1
C.CO(g)+1/2O2(g)=CO2(g) △H=-293KJ·mol-1
D.2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ·mol-1
2、选择题 向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3:1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
3、选择题 下列热化学方程式中的△H能表示物质燃烧热的是( )
A.2CO(g)+O2 (g)=2CO2(g)△H =
4、选择题 T℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是?
A.此时水的离子积Kw=1×10-12
B.水电离出的c(H+)=1×10-10 mol/L
C.水的电离度随温度升高而增大
D.若加入等体积pH=12的NaOH溶液,溶液呈中性
5、填空题 已知下列热化学方程式:①H2(g) +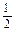 O2(g)=H2O(l) ΔH="-285" kJ·mol-1
O2(g)=H2O(l) ΔH="-285" kJ·mol-1
②H2(g) +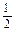 O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1?③C(s) +
O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1?③C(s) +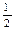 O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH="-393.5" kJ·mol-1?回答下列问题:
(1)H2的燃烧热为?;C的燃烧热为?。
(2)燃烧1gH2生成液态水,放出的热量为?。
(3)写出CO燃烧的热化学方程式?。