时间:2019-07-04 01:50:45
1、选择题 下列反应不属于氧化还原反应的是
A.2H2O2?2H2O+O2↑
B.CaCO3CaO+CO2↑
C.2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
D.2Cu+O2?2CuO
参考答案:B
本题解析:分析:有电子转移的化学反应是氧化还原反应,其特征是反应前后有元素化合价的变化.
解答:A.该反应中,双氧水中的氧元素部分得电子化合价降低,部分失电子化合价升高,所以是氧化还原反应,故A不选;
B.该反应中,各元素的化合价都不发生变化,所以不是氧化还原反应,故B选;
C.该反应中,氯元素得电子化合价降低,碳元素失电子化合价升高,所以该反应是氧化还原反应,故C不选;
D.该反应中,铜元素失电子,氧元素得电子,所以是氧化还原反应,故D不选;
故选B.
点评:本题考查了氧化还原反应的判断,根据元素化合价是否变化来分析判断即可,难度不大.
本题难度:困难
2、填空题 (8分)把煤作为燃料可通过下列两种途径:
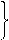 2CO(g)+O2(g) ="==" 2CO2(g)2H2(g)+O2(g) =2H2O(g)
2CO(g)+O2(g) ="==" 2CO2(g)2H2(g)+O2(g) =2H2O(g)参考答案:(1)等于(2分)(2)Q1 = Q3- Q2(2分)(3)小于(2分)(4)燃烧充分,节约能源,污染轻(2分)
本题解析:略
本题难度:一般
3、填空题 (1)现有可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据下图示回答:
cC(g)+ dD(g);根据下图示回答:

①上左图中压强 p1 p2(填“>”、“<”、“=”)
②反应式中(a +b) (c +d)(填“>”、“<”、“=”)
③上右图中温度t1℃ t2℃(填“高”或“低”)
④该反应的正反应为 反应(填“吸热”或“放热”)
(2)今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③
B.①<②<③
C.①=②=③ E.①>②=③
D.①=③>② F.①<②=③ G.①=②<③H.①=②>③
①当它们pH相同时,其物质的量浓度关系是 。
②当它们的物质的量浓度相同时,其pH的关系是 。
③中和等体积、等物质的量浓度的三种酸溶液,需同物质的量浓度的烧碱溶液的体积关系为 。
④当它们pH相同、体积相同时,同时加入锌,则开始时反应速率大小关系为 。
⑤将pH相同的三种酸均稀释10倍后,pH关系为
⑥当它们pH相同、体积相同时,同时加入足量的锌,最终收集到的氢气的体积关系为 。
参考答案:(1)①<;②<;③高;④吸热(2)①A;②A;③G;④C;⑤F;⑥ E
本题解析:(1)由P2的斜率大,所以P1<P2,压强大理A的转化率小,根据化学平衡移动的原理,(a +b)<(c +d),温度高,反应速率大,即对应的斜率陡,所以t1℃高t2℃,温度高,A的转化率小,根据化学平衡移动的原理,可以知道该反应的正反应为吸热反应;(2)醋酸为弱酸,盐酸为一元强酸,硫酸为二元强酸,所以①当它们pH相同时,其物质的量浓度关系是①>②>③;当它们的物质的量浓度相同时,其pH的关系是①>②>③;中和等体积、等物质的量浓度的三种酸溶液,需同物质的量浓度的烧碱溶液的体积关系为①=②<③;当它们pH相同、体积相同时,同时加入锌,则开始时反应速率大小关系为①=②=③;将pH相同的三种酸均稀释10倍后,pH关系为①<②=③;当它们pH相同、体积相同时,同时加入足量的锌,最终收集到的氢气的体积关系为①>②=③。
考点:化学平衡移动的方向、强弱酸
点评:本题综合考查了化学平衡移动的方向、强弱酸的相关知识,是一道综合性比较强的题目,但该题难度不大。
本题难度:一般
4、选择题 下列离子能在溶液中大量共存的是
A.Na+、Cl-、Ba2+、SO42-
B.H+、Na+、SO32-、Cl-
C.Fe2+、Na+、Cl-、OH-
D.Na+、H+、NO3-、SO42-
参考答案:D
本题解析:分析:离子之间不能结合生成水、气体、沉淀等,则离子能大量共存,以此来解答.
解答:A、因Ba2+、SO42-能结合生成沉淀,则不能共存,故A错误;
B、因H+、SO32-能结合生成水和二氧化硫气体,则不能共存,故B错误;
C、因Fe2+、OH-能结合生成沉淀,则不能共存,故C错误;
D、因该组离子之间不反应,则能够共存,故D正确;
故选D.
点评:本题考查离子的共存,熟悉复分解反应发生的条件及离子之间的反应即可解答,难度不大.
本题难度:困难
5、填空题 (14分)
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g)? △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g)? △H = -534.0 kJ·mol-1
NO2(g) 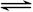 1/2N2O4(g)? △H = -26.35 kJ·mol-1
1/2N2O4(g)? △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
参考答案:(1)2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g)?△H = -1083.0 kJ·mol-1(4分)
(2)H?2-2e-+2OH-=2H2O (2分)? 2 (2分)
(3)2CO2+4e-+2H2O=2CO+4OH-(2分)
不能(2分)?△H>0,吸热,△S<0(2分)
本题解析:(1)考查盖斯定律的应用。根据①N2(g) + 2O2(g) =2NO2(g)、②N2H4(g) + O2(g) =N2(g) + 2H2O(g)和③NO2(g) 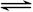 1/2N2O4(g)可知,如果②×2-①-③×2即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2-67.7 kJ/mol+26.35 kJ/mol×2="-1083.0" kJ/mol。
1/2N2O4(g)可知,如果②×2-①-③×2即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2-67.7 kJ/mol+26.35 kJ/mol×2="-1083.0" kJ/mol。
(2)在原电池中负极失去电子,发生氧化反应,所以氢气通入负极,反应式为H?2-2e-+2OH-=2H2O。水电解生成氢气和氧气,体积之比是2︰1。即氢气是22.4L,物质的量为1.0mol,所以转移的电子是2.0mol。
(3)在原电池中负极和正极的电极反应式相叠加即得到总反应式,所以根据总反应式和阳极(即负极)反应式可得到阴极(即正极)反应式为2CO2+4e-+2H2O=2CO+4OH-。由于反应2CO=2C+O2是吸热的,熵值减小的反应,所以是不能自发进行的。
本题难度:一般