时间:2019-07-04 01:36:59
1、选择题 下列说法中正确的是
[? ]
2、选择题 下图为短周期的一部分,推断关于Y、Z、M的说法正确的是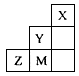
[? ]
A.非金属性:Y>Z>M
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:HaY<HaM<HbZ
D.ZM2分子中各原子的最外层电子均满足8电子稳定结构
3、选择题 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
[? ]
A.气态氢化物的稳定性:D>C
B.原子序数:B>A>C>D
C.最高价氧化物对应水化物的碱性:B>A
D.四种元素一定属于短周期元素
4、选择题 下列有关晶体的说法错误的是
[? ]
A.碘晶体升华时,化学键没有被破坏
B.晶体中分子间的作用力越大,分子越稳定
C.氯化钠溶于水或熔化时,离子键都被破坏
D.金刚石和足球烯(C60)都是碳元素的同素异形体
5、选择题 下列说法正确的是
A.高纯硅可以制作太阳能电池,其工作原理与原电池不相同
B.3O2(g)=2O3(g)ΔH>0,所以臭氧比氧气稳定
C.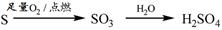 转化过程可以实现
转化过程可以实现
D.雷雨天气可以产生硝酸,会给人类带来危害