时间:2019-07-04 01:31:28
1、选择题 相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
参考答案:B
本题解析:A.因为同一反应在相同的温度下的平衡常数不变,故容器①、②中反应的平衡常数相等,正确;B.容器②中反应可视为是容器①已经反应了一部分,故达到平衡时放出的热量Q<23.15kJ,原说法不正确;C.容器①、②中达平衡时的等效的,由①可知生成n(XY3)= ×2mol=0.5mol,故c(XY3)=
×2mol=0.5mol,故c(XY3)= =2 mol·L-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
=2 mol·L-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
考点:同一反应不同的起始量达到的平衡数据比较。
本题难度:一般
2、选择题 对于反应H2(g)+Cl2(g)=2HCl(g)的能量变化描述正确的是
A.成键过程中吸收能量
B.断键过程中吸收能量,成键过程中释放能量
C.断键过程中释放能量
D.断键过程中释放能量,成键过程中吸收能量
参考答案:B
本题解析:化学反应H2(g)+Cl2(g)=2HCl(g)为放热反应,断键过程中吸收能量大于成键过程中释放能量,选B。
考点:考查化学反应中的能量变化。
本题难度:一般
3、选择题 下列叙述中正确的是?(?)?
A.单质分子中一定存在共价键
B.共价化合物中不一定存在共价键
C.除去乙烷中少量的乙烯可在光照条件下通入Cl2,然后进行气液分离
D.苯、乙醇和乙酸都能发生取代反应
参考答案:D
本题解析:很多单质没有共价键,如稀有气体,A错;共价化合物中一定存在共价键,B错;
乙烷在光照条件下与氯气反应,C错。
本题难度:一般
4、选择题 下列描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.中和反应都是放热反应
C.放热反应的反应速率总是大于吸热反应的反应速率
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的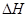 不同
不同
参考答案:B
本题解析:A、有些放热反应也需要加热,不选A;B、中和反应都是放热反应,选B;C、反应的速率取决于反应物的性质,不选C;D、反应热和反应的条件没有关系,不选D。
考点:反应的热效应。
本题难度:一般
5、选择题 A2+B2===2AB的反应历程可以看作如下(△H表示该过程的能量变化):
Ⅰ.A2==="A" +A △H 1 Ⅱ.B2==="B" +B △H 2 Ⅲ.A+B===AB △H 3
则下列说法中正确的是( )
A.当△H3+(△H1+△H2) >0时,该反应是吸热反应;
B.当 2△H3+(△H1+△H2) > 0时,该反应是放热反应;
C.当 2△H3+(△H1+△H2 ) <0时,该反应是放热反应;
D.当1/2△H3+(△H1+△H2)<0时,该反应是吸热反应;
参考答案:C
本题解析:根据盖斯定律可知,I+Ⅱ+Ⅲ×2即得到反应A2+B2===2AB,所以该反应的反应热是△H= 2△H3+(△H1+△H2 )。因此选项C正确,答案选C。
考点:考查反应热的计算和判断
点评:在根据多个热化学方程式计算有关的反应热时,盖斯定律是最重要的定律,需要熟练掌握并能灵活运用。
本题难度:一般