时间:2019-07-04 01:24:56
1、填空题 (共10分)常温下,如果取0.1 mol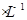 HA溶液与0.1mol
HA溶液与0.1mol 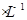 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):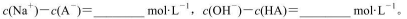
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH3)2CO3溶液的pH_____7(填“>”、“<”或“=”);
2、选择题 足量的二氧化碳通入到1mol/LNaOH溶液中,下列说法错误的是
[? ]
A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数)
B.溶液中的CO32-离子浓度先增大后减小
C.微热反应后的溶液,溶液的pH会升高
D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系:c?(Na+)?+?c?(H+)?=c?(HCO3-)?+2?c?(CO32-)?+?c?(OH-)
3、选择题 在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10 mL 0.1 mol/L的醋酸相比较,下列数值中,前者大于后者的是
A.H+的物质的量
B.醋酸的电离常数
C.中和时所需NaOH的物质的量
D.加足量锌粉产生氢气的质量
4、选择题 将0.1mol-L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A.溶液的pH增加
B.CH3COOH电离度变大
C.溶液的导电能力减弱
D.溶液中c(OH-)增大
5、填空题 (8分)今有a.盐酸? b.硫酸? c.醋酸三种酸,回答下列问题。(用酸的序号填写)
(1)在同体积、同浓度的三种酸中,分别加入足量的锌粒,在相同条件下产生H2的体积由大到小的顺序是_________________?;
(2)在同体积、同pH的三种酸中,分别加入足量的锌粒,在相同条件下产生H2的体积由大到小的顺序是_______________?;
(3)物质的量浓度均为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是___________? ?。 如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________?。
?。 如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________?。