时间:2019-07-04 01:24:33
1、选择题
A.2c(Na+)+c(H+)====c(S2-)+c(HS-)+c(OH-)
B.c(Na+)+c(H+)====2c(S2-)+c(HS-)+c(OH-)
C.c(H+)+c(HS-)+2(H2S)====c(OH-)
D.c(Na+)====2c(S2-)+2(HS-)+2c(H2S)
参考答案:A
本题解析:根据电荷守恒,可知A错B对。根据由水电离产生的H+和OH-个数相等,可知C对。根据Na2S中,Na+个数是S2-的两倍,可知D对。
本题难度:一般
2、填空题 (6分)下列10种物质中:①NaOH溶液②H2SO4③硫酸铜晶体④Cu ⑤CH3COOH ⑥NaOH固体⑦蔗糖⑧石灰水⑨水银⑩氨水
能导电的有 ;属于强电解质的有 ;属于弱电解质的有 。
参考答案: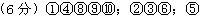
本题解析:略
本题难度:简单
3、选择题 下列事实能证明HNO2是弱电解质的是(?)
A.用HNO2溶液做导电性试验灯光较暗
B.HNO2是共价化合物
C.常温下,0.1 mol/L HNO2溶液的pH为2.2
D.HNO2溶液不与NaCl反应
参考答案:C
本题解析:弱电解质必然存在电离平衡,电解质不能全部电离。如果HNO2是强电解质,0.1 mol/L HNO2溶液的PH应该是1,既然为2.2,酸性偏小,说明它没有全部电离,为弱电解质。另,A中没有标明浓度的情况下做导电性试验并不能说明它是否全部电离,B:共价化合物也可以全部电离或不电离,并不能说明它是否部分电离;D:只说明它与NaCl不反应,并不能它是否部分电离!故答案为C。
本题难度:简单
4、选择题 在醋酸溶液中,CH3COOH电离达到平衡的标志是
A.溶液显电中性
B.溶液中检测不出CH3COOH分子存在
C.氢离子浓度恒定不变
D.c(H+)=c(CH3COO-)
参考答案:C
本题解析:电离平衡为:CH3COOH CH3COO—+H+
CH3COO—+H+
溶液本身就是电中性,排除A;由于醋酸为弱电解质,不可能全部电离,所以溶液中任何时间都能检测出CH3COOH分子,排除B;在电离过程中c(H+)与c(CH3COO-)任何时候都相等,也不能做为平衡标志,排除D;故答案为C:当氢离子浓度不变时,电离达到平衡
本题难度:简单
5、选择题 有0.1 mol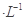 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,C(CH3COO-)=C(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+)
D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-)
参考答案:C
本题解析:A、溶液①中,醋酸电离产生的C(CH3COO-)=C(H+),但溶液中的C(CH3COO-)<C(H+),错误;B、溶液①、②等体积混合,混合液的CH3COONa的浓度为0.05 mol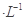 ,所以混合液中c(CH3COO-)小于溶液③中的C(CH3COO-),错误;C、溶液①、②等体积混合,混合液的CH3COONa的浓度为0.05 mol
,所以混合液中c(CH3COO-)小于溶液③中的C(CH3COO-),错误;C、溶液①、②等体积混合,混合液的CH3COONa的浓度为0.05 mol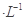 ,根据物料守恒规律,有c(CH3COO-)+ c(CH3COOH)= C(Na+)="0.05" mol
,根据物料守恒规律,有c(CH3COO-)+ c(CH3COOH)= C(Na+)="0.05" mol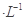 ,正确;D、溶液①、③等体积混合,溶液为酸性,所以C(CH3COO-)> C(Na+),错误,答案选C。
,正确;D、溶液①、③等体积混合,溶液为酸性,所以C(CH3COO-)> C(Na+),错误,答案选C。
本题难度:一般