时间:2019-07-04 01:06:25
1、填空题 化学兴趣小组为探究某铁矿石(主要成分为Fe203和Si02)的性质,进行如下实验:
(1)步骤(I)中分离溶液和沉淀的操作名称是______;
(2)沉淀A中一定含有______,该物质属于______(填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈______(填“黄色”或“红色”);
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式______.
参考答案:(1)铁矿石的主要成分为Fe203和Si02,加入足量盐酸后,氧化铁与盐酸反应生成氯化铁和水,二氧化硅为难溶物且不与盐酸反应,可以通过过滤的方法分离,
故答案为:过滤;
(2)二氧化硅不与盐酸反应,所以过滤后得到的沉淀A为SiO2;二氧化硅能够与强碱溶液反应生成盐和水,所以二氧化硅属于酸性氧化物,
故答案为:SiO2;酸性氧化物;
(3)滤液中含有铁离子,铁离子能够与硫氰根离子反应生成红色的硫氰化铁,
故答案为:红色;
(4)步骤Ⅱ为铁离子与氢氧化钠溶液反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓.
本题解析:
本题难度:一般
2、选择题 下列有关纯铁的叙述正确的是(?)
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在冷的浓硫酸中可以钝化
D.在潮湿空气中比生铁容易被腐蚀
参考答案:C
本题解析:生铁是铁和碳的合金,由于合金的熔点低于组成成分中任一物质的熔点,所以纯铁的熔点比生铁的高;由于生铁与盐酸反应时,铁、碳和盐酸形成无数微小的原电池,加快了反应速率,所以与相同浓度的盐酸反应生成氢气的速率纯铁比生铁的慢;铁在冷的浓硫酸中可以钝化;生铁在潮湿空气中,铁、碳形成原电池发生吸氧腐蚀,加快了腐蚀速率,所以在潮湿空气中纯铁比生铁腐蚀得慢,故选C项。
本题难度:简单
3、选择题 某同学采用下图所示装置进行Fe粉与水蒸气的反应。
(1)写出Fe粉与水蒸气反应的化学方程式________________。
(2)该同学向反应后的固体中加入过量的稀 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有______。
②向第二支试管中加入适量铁粉。该过程中发生化合反应的离子方程式是________。
再向所得溶液中滴加 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。
发生的氧化还原反应的化学方程式是________________。
参考答案:(1)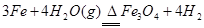 (2分)
(2分)
(2)①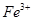 、
、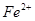 、
、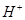 (2分)
(2分)
②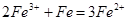 (2分)?产生白色沉淀,迅速变成灰绿色,最终变成红褐色(2分)
(2分)?产生白色沉淀,迅速变成灰绿色,最终变成红褐色(2分)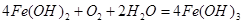 (2分)
(2分)
本题解析:(1)铁与水高温下的反应生成四氧化三铁和氢气的反应。(2)四氧化三铁与盐酸的反应和三价铁与二价铁的转化,及氢氧化亚铁和氢氧化铁的转化。
本题难度:一般
4、填空题 (6分)中学化学常见的物质A、B、C、D、E、X有如图所示转化关系。已知A、D是单质,B为氧化物,反应①在高温下发生。
(1)若A、D、X为非金属单质,E是常见的温室气体,则A为____________,X为___________(用化学式填空)。
(2)若A为金属单质,D为非金属单质,X为盐酸,则反应①的化学方程式为________________;反应②的离子方程式________________________________。
参考答案:(1)C(1分),O2(1分)?
⑵①3Fe+4H2O(g)高温Fe3O4+4H2? (2分,无条件-1分)?
②Fe3O4+8H+==Fe2++2Fe3++4H2O(2分)
本题解析:题目中信息提示:A与B反应生成C和D,这一反应是典型的置换反应,在(1)中,高温下非金属置换非金属的反应典型的为:C+H2O=CO+H2?(2)中高温下金属置换非金属的反应典型的为3Fe+4H2O(g) ="=" Fe3O4+4H2
本题难度:一般
5、填空题 活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是?。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象?。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于?。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式。(请写出计算过程)
参考答案:(1)有利于加快反应池中反应速率
(2)取2份待检液,其中一份待检液滴入KSCN溶液,若显示血红色则含有Fe3+,再向另一份待检液滴入酸性高锰酸钾溶液,若紫红色褪去则含有Fe3+
(3)4:1(3分)?(4) Fe5O7或FeO·2Fe2O3(5分)除标示外,其余每空2分
本题解析:(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是增大反应物的接触面积,有利于加快反应池中反应速率 。(2)由于Fe3O4不溶于水但能溶于酸,如与盐酸反应的产物中含有Fe2+、Fe3+,可分别对两种离子进行检验,根据提供的试剂方法如下:取2份待检液,其中一份待检液滴入KSCN溶液,若显示血红色则含有Fe3+,再向另一份待检液滴入酸性高锰酸钾溶液,若紫红色褪去则含有Fe3+。(3)没有气体产生,说明铁刚好使三价铁转化为二价铁,由于在1molFe3O4中可以认为有二价的氧化亚铁和三价的三氧化铁各1mol,设Fe为Xmol,Fe2O3为ymol,生成1molFe3O4,根据Fe+2Fe3+=3Fe2+则有:X+2Y=3,3X=1,解得X=1/3;Y=4/3,故铁和三氧化铁的物质的量为1:4。(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式。(请写出计算过程) 根据2Fe2++Cl2=2Fe3+ +2 Cl-,由224 mLCl2可知氯气的物质的量为0.01mol,Fe2+为0.02mol。得到8 g固体为三氧化二铁,物质的量为0.05mol,则Fe3+为0.03mol,故化学式为Fe10O13或4FeO·3Fe2O3。
本题难度:一般