时间:2019-07-04 01:05:23
1、选择题 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
A.还原荆是含CN-的物质,氧化产物只有N2
B.氧化剂足ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2(标准状况).则转移电子0.5mol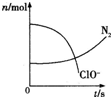
参考答案:C
本题解析:
本题难度:一般
2、选择题 某一条件下NH4NO3受热分解的方程式为NH4NO3→N2+HNO3+H2O(未配平),则该反应中氧化产物和还原产物之比为( )
A.1:1
B.5:3
C.4:9
D.3:5
参考答案:B
本题解析:
本题难度:一般
3、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol 硝酸锌时,被还原的硝酸的物质的量为
[? ]
A.2 mol
B.1 mol
C.0.5 mol
D.0.25 mol
参考答案:D
本题解析:
本题难度:一般
4、选择题 在铜—锌—稀硫酸构成的原电池中,当导线中有1?mol电子通过时,理论上的两极变化是
[? ]
①锌片溶解了32.5?g ②锌片增重了32.5?g ③铜片上析出1?g?H2 ④铜片上析出1?mol?H2
A.①③?
B.①④
C.②③?
D.②④
参考答案:A
本题解析:
本题难度:一般
5、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol 硝酸锌时,被还原的硝酸的物质的量为
[? ]
参考答案:D
本题解析:
本题难度:一般