时间:2019-07-04 01:03:48
1、填空题 (1)设计一个简单的一次性完成实验的装置,验证醋酸、二氧化碳水溶液(碳酸)和苯酚的酸性,其强弱的顺序是:CH3COOH> H2CO3> C6H5OH
①利用下列仪器可以组装实验装置,则仪器的连接顺序是:?。
②写出实验过程中发生反应的离子方程式。?、?。
(2)若1 mol  分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是?mol和?mol。
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是?mol和?mol。
参考答案:(10分)(1)ADEBCF(2)2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
H2O+CO2+C6H5O-→ C6H5OH+HCO3-?(2)3?和? 3
本题解析:(1)根据较强的酸制备较弱的酸可知,要证明醋酸的酸性强于碳酸的,则应该将醋酸滴入碳酸钠中,然后将生成的CO2通入到苯酚钠中即可,所以正确的连接顺序是ADEBCF。
(2)实验过程中发生反应的离子方程式有2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑、H2O+CO2+C6H5O-→ C6H5OH+HCO3-。
(3)根据有机物的结构简式可知,分子中含有2个酚羟基、1个氯原子、1个碳碳双键,所以能和2mol单质溴发生取代反应,1mol溴发生加成反应,共计是3mol。2mol酚羟基需要2mol氢氧化钠,1mol氯原子水解又需要1mol氢氧化钠,共计是3mol。
点评:该题是基础性试题的考查,试题侧重对学生基础知识的巩固和训练,意在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是记住常见官能团的结构、性质以及官能团之间的相互转化,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范的实验设计能力。
本题难度:一般
2、实验题 某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶) 
参考答案:Ⅰ、Ca2++SO42-==CaSO4↓
Ⅱ、反应存在限度,尚有大量Ca2+
Ⅲ、产生大量白色沉淀
Ⅳ、Ca2++CO32-=CaCO3↓
Ⅴ、加入CO32-产生了大量的白色沉淀,说明Ca2++SO42-==CaSO4反应是可逆反应,存在反应限度,所以
Ca2+不能反应完,才出现这种现象。
本题解析:
本题难度:困难
3、选择题 下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入HNO3, 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为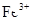 |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 参考答案:D 本题解析: 本题难度:一般 4、实验题 某中学高一课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验。 参考答案:(1)①Cu+2H2SO4(浓) 本题解析: 本题难度:困难 5、简答题 如图所示为实验室制取少量硝基苯的装置.根据题意完成下列填空: 参考答案:(1)实验室用浓硝酸和苯在浓硫酸作用下制备硝基苯,反应的化学方程式为 本题解析: 本题难度:一般 |