时间:2019-07-04 01:03:24
1、填空题 人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质。
(1)医疗上常用_____________(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是?;
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:____________________、 ? ___________________________;
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和?,用?可以鉴别(填化学专用名词)。
参考答案:⑴FeSO4(1分); 防止亚铁离子被氧化 (1分)?;
⑵ Al(OH)3+3H+==Al3++3H2O (2分) 、? HCO3- +H+="==" H2 O + CO2↑(2分);
(3)胶体?丁达尔效应(每空1分)
本题解析:略
本题难度:一般
2、选择题 要除去FeCl2溶液中的少量氯化铁,可行的办法(?)
A.加入KSCN溶液
B.通入氯气
C.加入NaOH 溶液
D.加入铁粉
参考答案:D
本题解析:本题考查物质的分离提纯,结合主体物质及杂质的性质分析,除杂时遵循的原则为:除去杂质时不能增加新的杂质;不减少被提纯的物质;操作简单易行,易分离。A、加入KSCN溶液,铁离子与KSCN反应生成硫氰合铁离子,难以分离,错误;B、通入氯气,氯气与亚铁离子反应生成铁离子,减少了主体物质,错误;C、加入NaOH 溶液,亚铁离子与氢氧化钠反应生成氢氧化亚铁沉淀,减少了主体物质,错误;D、加入铁粉,铁离子能和铁反应生成亚铁离子,可用铁除去FeCl2溶液中的少量氯化铁,正确。
本题难度:一般
3、填空题 Fe(OH)2在空气中极易被氧化,而使实验室制取存在一定困难,人们尝试用多种方法来制得白色的Fe(OH)2沉淀。 ?
?
(1)方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①配制FeSO4溶液时,在蒸馏水中加入硫酸亚铁晶体外还需加入??。
②除去蒸馏水中溶解的O2常采用?的方法。
(2)方法二:用电解法制Fe(OH)2,实验装置如上左图所示。
①电解时,电解质溶液应选用下列试剂中的?(填编号字母)
A.氯化钠溶液
B.稀硫酸
C.硫酸铜溶液
D.碳酸钠溶液
②电解时阴极的电极反应为:? ??。
??。
③电解质溶液液面复盖一层苯所起的作用是??。
(3)方法三:在如上图右装置,先打开止水夹,反应一段时间后关闭止水夹, 右侧试管内可见到白色沉淀。
右侧试管内可见到白色沉淀。
①该法可使沉淀的白色维持较长时间,其原因是?。
②该法操作不当,在右侧试管中得不到沉淀,其原因是??。
参考答案:(1) ①稀H2SO4 、铁屑?②煮沸
(2)①A?②2H2O +2e- = H2↑+2OH-?或2H++2e-==H2↑
③隔绝空气,防止氢氧化亚铁被氧化
(3)①试管内充满了氢气,外界空气不易进入
②过早关闭止水夹,使左侧试管的硫酸压入右侧试管中,将氢氧化钠溶液中和了
本题解析:略
本题难度:一般
4、实验题 碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu
的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答下列问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+(x+y)H2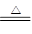 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O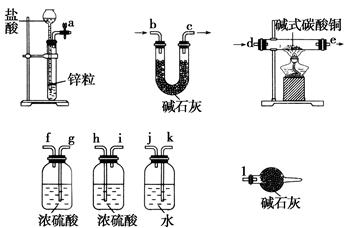
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________
参考答案:(1)①k j g(或h) f(或i) d e h(或g) i(或f) b c
②1.8 CuCO3·Cu(OH)2·H2O
(2)可行。根据反应xCuCO3·yCu(OH)2·zH2O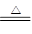 (x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O的质量(或其中任意三个量),即可计算出其组成
(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O的质量(或其中任意三个量),即可计算出其组成
本题解析:(1)①由实验目的和实验装置知,该实验要测定生成的水、二氧化碳的量,而从a口出来的氢气中含有水蒸气和挥发出来的氯化氢,会对实验有干扰,所以应先用水吸收氯化氢,再用浓硫酸吸收水蒸气,再通入碱式碳酸铜中发生反应,而产生的两种气体应先用浓硫酸吸收水蒸气,再用U形管中的碱石灰吸收二氧化碳,同时要连接上装有碱石灰的球形干燥管,防止空气中的水蒸气和二氧化碳进入U形管而产生误差。②根据所给数据可计算出生成的铜、二氧化碳、水的物质的量分别为0.2 mol、1 mol、0.4 mol,所以可知(x+y)∶x∶(x+2y+z)=2∶1∶4,故x、y、z分别为1、1、1,从而求得碱式碳酸铜样品的化学式及结晶水的质量。
(2)若以氮气代替氢气,则原理是利用碱式碳酸铜热分解的化学方程式:
xCuCO3·yCu(OH)2·zH2O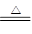 (x+y)CuO+xCO2↑+(y+z)H2O↑,要想完成实验目的,知道碱式碳酸铜、CuO、CO2和H2O的质量(或其中任意三个量)即可。
(x+y)CuO+xCO2↑+(y+z)H2O↑,要想完成实验目的,知道碱式碳酸铜、CuO、CO2和H2O的质量(或其中任意三个量)即可。
本题难度:一般
5、填空题 四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: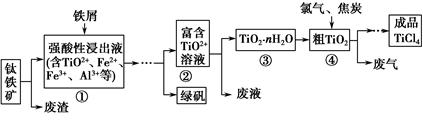
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是?。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在?范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=?。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)? ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:?。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是?(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用?方法。
| ? | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
参考答案:(1)使Fe3+还原为Fe2+;保护TiO2+不被Fe3+氧化
(2)10-9 m~10-7 m(或其他合理答案)
(3)2.79×103
(4)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(5)产生三废(或其他合理答案)
(6)蒸馏(或分馏或精馏)
本题解析:(1)由题目所给的反应可以看出加入铁屑使溶液中的Fe3+转化为Fe2+,保护TiO2+不被Fe3+氧化。
(3)由Ksp[Fe(OH)3]=2.79×10-39可得c(Fe3+)·c3(OH-)=2.79×10-39
K= =
= =
= =2.79×103。
=2.79×103。
(4)利用盖斯定律:两个热化学方程式相加即得所要的热化学方程式TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1。
(5)由工业流程图可以得出该生产过程中产生了工业三废。
(6)TiCl4与SiCl4的沸点差异很大,所以采用蒸馏的方法进行分离。
本题难度:困难