时间:2019-07-04 01:02:54
1、选择题 NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,1mol水含有NA个H+和NA个OH-离子
B.在通常状况下,22.4?LH2和4?gHe均含有NA个分子
C.8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
参考答案:C
本题解析:分析:A、水是弱电解质存在电离平衡;
B、22.4?LH2在通常状况下不是1nol;
C、质量换算物质的量分别计算物质含有的铜原子比较;
D、等物质的量铁和氯气反应生成三氯化铁,结合化学方程式的过量计算判断;
解答:A、水是弱电解质不能完全电离,故A错误;
B、在通常状况下,22.4?LH2物质的量不是1mol,故B错误;
C、8.0?g?若全是Cu2S含铜原子= =0.1mol;8.0?g?若全是CuO含铜原子=
=0.1mol;8.0?g?若全是CuO含铜原子= =0.1mol;所以8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA,故C正确;
=0.1mol;所以8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA,故C正确;
D、0.1mol铁与0.1molCl2充分反应铁有剩余,转移电子数用全反应的氯气计算为0.2mmol,故D错误;
故选C.
点评:本题考查了弱电解质的电离平衡,气体摩尔体积的条件应用,质量换算物质的量计算微粒数,氧化还原反应的过量计算电子数的计算.
本题难度:一般
2、选择题 在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为
A.0.2mol/L
B.0.25mol/L
C.0.45mol/L
D.0.225mol/L
参考答案:C
本题解析:分析:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)= ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=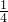 ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
解答:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)= ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=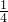 ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
故选:C.
点评:本题考查有关混合物的计算,题目浓度不大,注意根据质量守恒和电荷守恒的角度解答.
本题难度:困难
3、选择题 下列各溶液中,钠离子的物质的量浓度最大的是
A.50mL0.4mol/LNaOH溶液
B.40mL0.5mol/LNaCl溶液
C.30mL0.15mol/LNa3PO4溶液
D.20mL0.3mol/LNa2SO4
参考答案:D
本题解析:分析:根据溶质的化学式及物质的量浓度来计算钠离子的物质的量浓度,据此进行判断.注意离子浓度与溶液体积无关系.
解答:A、0.4mol/LNaOH溶液中钠离子浓度为0.4mol/L;
B、0.5mol/LNaCl溶液中钠离子浓度为0.5mol/L;
C、0.15mol/LNa3PO4溶液中钠离子浓度为0.45mol/L;
D、0.3mol/LNa2SO4液中钠离子浓度为0.6mol/L;
故0.3mol/LNa2SO4液中钠离子浓度最大.
故选:D.
点评:本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,所含微粒的物质的量浓度与所取溶液的体积大小无关.
本题难度:困难
4、选择题 研究物质性质的基本程序是一个系统化的过程.下列各项中,属于研究物质性质一般程序的第二步的是
A.预测物质性质
B.观察物质的外观性质
C.进行实验和观察
D.做出有关解释和结论
参考答案:A
本题解析:分析:对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论.
解答:对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论,第二步是预测物质性质,故选A.
点评:本题考查研究物质性质的基本程序,熟记教材知识是关键,难度不大.
本题难度:一般
5、选择题 物质的体积一定是22.4L的是
A.1?mol氧气
B.标准状况下44?g二氧化碳
C.0℃、2×105?Pa时2?g氢气
D.17?g氨气
参考答案:B
本题解析:分析:标准状况下1mol气体的体积约为22.4L,依据概念进行分析计算判断.
解答:A、1mol氧气,在标准状况下体积是22.4L,但温度压强不知,体积不一定是22.4L,故A错误;
B、标准状况下44g二氧化碳,为1mol,所以标准状况下气体体积为22.4L,故B正确;
C、0℃、2×105Pa时2g氢气物质的量是1mol,但不是标准状况下,所以体积不一定为22.4L,故C错误;
D、17g氨气物质的量为1mol,但具体温度和压强不知,无法判断,故D错误;
故选B.
点评:本题考查了气体摩尔体积的概念和应用条件,注意物质的状态必须是气体.题目较简单.
本题难度:一般