时间:2019-07-04 01:00:04
1、简答题 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置______.
(2)写出反应①、⑥的化学方程式.
反应①:______;
反应⑥:______.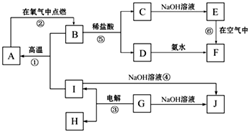
参考答案:(1)G主族元素的固态氧化物,可以和氢氧化钠反应,判断为两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,所以A、B、C、D、E、F六种物质中所含的同一种元素是Fe,Fe位于周期表中在第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)由(1)分析可知,反应①Fe3O4为与Al在高温下发生铝热反应生成Fe,反应的方程式为8Al+3Fe3O4?高温?.?9Fe+4Al2O3,反应⑥为具有还原性的Fe(OH)2与空气中的氧气反应生成Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:8Al+3Fe3O4?高温?.?9Fe+4Al2O3;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
本题解析:
本题难度:一般
2、简答题 如图表示A--E五种含氮物质相互转化的关系图.其中A、B、C、D常温下都是气体,B为红棕色,写出各步反应的化学方程式.
①______
②______
③______
④______.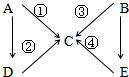
参考答案:B为红棕色,应为NO2,根据NO2的性质可知NO2反应能分别生成NO和HNO3,则C应为NO,E为HNO3,NO2可与水反应生成
NO,稀HNO3可与Cu反应生成NO,含N元素物质中能生成NO的还有N2和NH3,其中N2和氢气反应还可生成NH3,
则分别是:A:N2,B:NO2,C:NO,D:NH3,E:HNO3,
反应①的方程式为N2+O2放电.2NO,
反应②的方程式为4NH3+5O2催化剂.高温高压4NO+6H2O,
反应③的方程式为3NO2+H2O=2HNO3+NO,
反应④的方程式为8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O,
故答案为:N2+O2放电.2NO;4NH3+5O2催化剂.高温高压4NO+6H2O;3NO2+H2O=2HNO3+NO;8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O.
本题解析:
本题难度:一般
3、简答题 如图表示某典型金属单质A与其化合物之间的转化关系(某些产物和反应条件已略去).已知:图中所示物质中的组成元素均为短周期元素,化合物C中含有两种金属元素,反应⑤用于工业制取A,反应⑥的产物过滤后得到化合物D的溶液呈碱性.
(1)一步实现图中①至⑥的转化关系中一定属于复分解反应的是______?(填序号).
(2)写出一步实现反应④所需加入的化学试剂(填化学式);______.
(3)写出反应①的离子反应方程式:______.
(4)B→C的转化有多种途径,试写出其中两种不同反应类型的化学反应方程式:______;.______.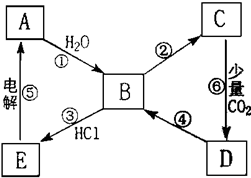
参考答案:典型金属单质A可与水反应,应为Na,则B为NaCl,E为NaCl,C为NaAlO2,D为Na2CO3,Na2CO3可与Ca(OH)2?或?Ba(OH)2反应生成NaOH,则
(1)由以上物质的转化可知,①Na→NaOH,②NaOH→NaAlO2,③NaOH→NaCl,④Na2CO3→NaOH,⑤NaCl→Na,⑥NaAlO2→Na2CO3,属于复分解反应有③④⑥,
故答案为:③④⑥;
(2)反应④为Na2CO3→NaOH,Na2CO3可与Ca(OH)2?或?Ba(OH)2反应生成NaOH,
故答案为:Ca(OH)2?或?Ba(OH)2;
(3)反应①为Na和水的反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(4)B→C的转化为NaOH→NaAlO2,可通过等Al→NaAlO2,AlCl3→NaAlO2,Al(OH)3→NaAlO2,Al2O3→NaAlO2等反应实现,反应的可分成两种类型:氧化还原:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
非氧化还原:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O 或Al(OH)3+NaOH=NaAlO2+2H2O或Al2O3+2NaOH=2NaAlO2+H2O.
故答案为:氧化还原:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;非氧化还原:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O 或Al(OH)3+NaOH=NaAlO2+2H2O或Al2O3+2NaOH=2NaAlO2+H2O.
本题解析:
本题难度:一般
4、填空题 (16分)A 、B 、C 、D 、E 、F、G为原子序数依次增大的元素,其中前六种属于短周期元素。已知B 、C 、F 三种原子的最外层共有11 个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应并且生成盐和水。请完成下列问题:
(1)只根据以上条件一定能判断出的元素的及符合条件的离子的符号填写在下表空格处
| 编号 | A | B | C | D | E | F | G | 半径最小的离子 |
| 符号 | ? | ? | ? | ? | ? | ? | ? | ? |
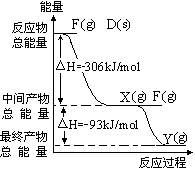 ?(2)写出B、C 的最高价氧化物对应的水化物间反
?(2)写出B、C 的最高价氧化物对应的水化物间反参考答案:(1) 各1分
A
B
C
D
E
F
半径最小的离子
?
Na
Al
?
?
Cl
Al3+
?(2)OH-+Al(OH)3=AlO2-+2H2O(2分)
(3)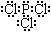 ,P(s)+2.5Cl2(g)=PCl5(g);△H = -399kJ/mol:(各2分)
,P(s)+2.5Cl2(g)=PCl5(g);△H = -399kJ/mol:(各2分)
(4)负极:Fe一2e-=Fe2+,正极:O2+2H2O+4e-=4OH-(各2分) (5)SO3(2分)
本题解析:由B、C、F最高价氧化物对应的水化物的性质知有铝元素,再结合原子序数及价电子数关系知B是钠,C是铝、F是氯;另外四种无法确定,己确定的元素中离子半径最小的是Al3+。由D是与氯气反应现象及产物种类知D是磷,它在氯气燃烧可生成PCl3、PCl5两种物质,其中PCl3满足8电子结构,由图示知,生成1molPCl5时放出的热量是399kJ。由此也可知道E是硫。由有关G的信息知其是铁,发生的腐蚀主要形式为吸氧腐蚀。A是原子序数比钠小的元素,与硫能形成两种常见化合物,故它是氧,其中SO3是非极性分子。
本题难度:一般
5、填空题 已知X、Y、Z都是中学化学中的常见三种气体,X为黄绿色,向X的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液颜色无明显变化;向Y的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液又呈红色;向Z的水溶液中滴入红色石蕊试液,溶液呈蓝色.据此回答下列问题:
(1)试写出下列物质的化学式:Y______、Z______.
(2)将X通入Y的水溶液中发生反应的化学方程式是______.
(3)往Z水溶液中通入少量Y,发生反应的化学方程式是______.
参考答案:X为黄绿色,应为Cl2,向Y的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液又呈红色,应为SO2,向Z的水溶液中滴入红色石蕊试液,溶液呈蓝色,应为NH3,
(1)由以上分析可知Y为SO2,Z为NH3,故答案为:SO2;NH3;
(2)SO2与Cl2在水溶液中发生氧化还原生成硫酸和盐酸,反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
(3)在氨水中通入少量二氧化硫生成亚硫酸铵,反应的方程式为2NH3+SO2+H2O=(NH4)2SO3,
故答案为:2NH3+SO2+H2O=(NH4)2SO3.
本题解析:
本题难度:简单