时间:2019-07-04 00:56:20
1、选择题 下列溶液一定呈中性的是( )
A.PH=7的溶液
B.0.1mol/L的Na2CO3溶液
C.C(H+)=1×10-7?mol/L
D.C(H+)=C(OH-)
2、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
[? ]
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
3、选择题 下列比较中正确的是
[? ]
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN
B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.2 mol/L NH4Cl和0.1 mol/L NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.将①pH=2的CH3COOH溶液②pH=2的盐酸③pH=12的氨水④pH=12的NaOH溶液稀释相同倍数后溶液的pH:③>④>①>②
4、简答题 运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=______;用离子方程式表示FeCl3溶液用于净水的原因:______.
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-.在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7.
(3)将等体积的Na2SO4溶液和BaCl2溶液混合,若Na2SO4溶液的浓度为0.02mol/L,则生成BaSO4沉淀所需BaCl2溶液的最小浓度为______.已知Ksp(BaSO4)=1.1×10-10.
(4)分析下表提供的数据:
| 化学式 | 电离常数 HClO Ka=3×10-8 |
| H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11 |
5、选择题 常温下,向20?mL?0.2?mol/L?H2A溶液中滴加0.2?mol/L?NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是? 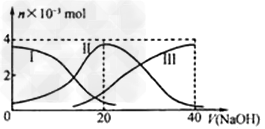
[? ]
A.当V(NaOH)=20?mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>?c(A2-)>c(OHˉ) ?
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 ?
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)? ?
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小