时间:2019-07-04 00:55:04
1、选择题 一定量的盐酸跟足量的镁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的
A.NaOH(固)
B.NaCl溶液
C.Na2CO3固体
D.Zn粉
参考答案:B
本题解析:
本题难度:一般
2、选择题 等物质的量的两份稀硫酸a和b中,分别加入过量的锌粉,并向a中加入少量硫酸铜,下图表示产生H2的体积(V)与时间(t)的关系正确的是
[? ]
A.
B.
C.
D.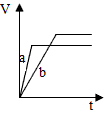
参考答案:A
本题解析:
本题难度:一般
3、选择题 用两根铜棒做电极,电解硝酸银溶液,跟电源正极相连的一极发生的电极反应是( ? )
A.Cu-2e-=Cu2+
B.4OH--4e-=2H2O+O2↑
C.2H++2e-=H2↑
D.Ag++e-=Ag
参考答案:A
本题解析:
本题难度:一般
4、填空题 (10分)金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。

(1)铜铬构成原电池如右图1,其中盛稀硫酸烧杯中的现象为: 。盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是:
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色。写出正极电极反应式: 。
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气。请解释这两种现象的原因___________。
参考答案:(1)铜电极上有气泡产生;(2分) B(2分) (2)4H++NO3-+3e-=NO↑+2H2O(2分)
(3)Cu2+的水解使溶液呈酸性,铬与酸性溶液反应生成氢气,气泡使生成的铜疏松;(2分)生成的铜和铬形成原电池,使产生氢气的速率加快。(2分)
本题解析:(1)铜铬构成原电池如右图1,由于铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4),这说明铬电极是负极,铜电极是正极,氢离子放电,所以盛稀硫酸烧杯中的现象为铜电极上有气泡产生;A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,当盐桥中不一定均可以用饱和KCl琼脂溶液,A错误;B.理论上1molCr溶解,则转移2mol电子生成1molCr2+,同时消耗2mol氢离子,所以根据溶液的电中性可知盐桥中将有2molCl-进入左池,2molK+进入右池,B正确;C.此过程中H+得电子,发生还原反应,C错误;D.电子不能在溶液中传递,D错误,答案选B。
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色,说明溶液中的硝酸根得到电子,产生NO,NO被氧化生成NO2,因此铜是负极,铬是正极,则正极电极反应式4H++NO3-+3e-=NO↑+2H2O。
(3)由于Cu2+的水解使溶液呈酸性,铬与酸性溶液反应生成氢气,气泡使生成的铜疏松。生成的铜和铬形成原电池,因此使产生氢气的速率加快。
考点:考查电化学原理的应用
本题难度:困难
5、填空题 (15分)回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:
已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
参考答案:(1)①过滤(2分)②C(2分)③否(1分);不能除去亚铁离子,影响所得氯化铜纯度(2分)(2)-320KJ/mol(3分)(3)H2O2+2H++2e-=2H2O(2分)(4)4(3分)
本题解析:(1)①操作是将固体和液体分开,用过滤。②利用印刷电路板上的铜制备CuCl2,反应后的溶液中有铁元素,说明使用的是氯化铁,选C。③需要将溶液中的铁元素变成沉淀,若以氢氧化亚铁的沉淀形式,溶液的pH在7.6到9.6之间,而铜离子已经沉淀,不能分离,若以氢氧化铁的形式沉淀,pH2.7开始沉淀,到3.7沉淀完全,这时铜离子没有开始沉淀,所以要将亚铁氧化成铁离子才能调节溶液的pH值进行沉淀,所以不可行,选否;因为那样不能除去亚铁离子,会影响所得氯化铜纯度。(2)根据盖斯定律,将方程式进行四则运算,③+②/2-②,则反应热=+64-196/2-286=-320KJ/mol。(3)原电池中铜做负极,过氧化氢在正极反应得到电子,电极反应为:H2O2+2H++2e-=2H2O。(4)根据离子方程式分析:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,生成3摩尔硫酸铜,需要3摩尔铜,2摩尔硝酸,所以硝酸的体积为2/0.5=4升。
考点:原电池的电极反应的书写,物质的分离,盖斯定律
本题难度:困难