时间:2019-07-04 00:44:55
1、选择题 下列有关金属铝及其化合物的叙述正确的是
[? ]
参考答案:C
本题解析:
本题难度:简单
2、填空题 在铝质易拉罐中收集满CO2气体,然后倒入10mL浓NaOH溶液,迅速密封易拉罐口,可观察到易拉罐突然变瘪了,一段时间后,又可观察到的现象是______.出现上述现象的原因是______,写出有关的两个化学方程式:______、______.
参考答案:CO2属于酸性氧化物,能和NaOH反应生成盐和水,反应方程式为2NaOH+CO2═Na2CO3+H2O,二氧化碳被吸收,导致容器内压强减小,则易拉罐突然变瘪;反应一段时间后,Al和NaOH溶液反应生成NaAlO2和H2,反应过程中生成氢气,导致容器内压强增大,则铝罐膨胀,反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:铝罐膨胀;铝和氢氧化钠溶液反应生成氢气;2NaOH+CO2═Na2CO3+H2O;2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
本题解析:
本题难度:一般
3、推断题 (12分)A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。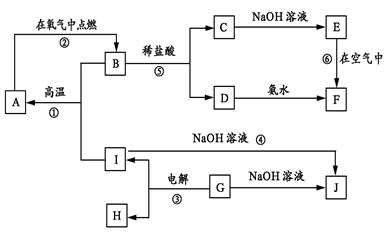
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是?(写元素符号)。
(2) 写出物质C、G的化学式:C?,G?。
(3) 写出反应①、④的化学方程式:反应①:?。反应④:?。
参考答案:
(1)Fe?(2) FeCl2? Al2O3?
(3) 8Al? +? 3Fe3O4 ?4Al2O3? + 9Fe
?4Al2O3? + 9Fe
4Fe(OH)2? +? O2? + 2H2O? =? 4Fe(OH)3
本题解析:
由G是一种“两性氧化物”可知为Al2O3,由图可知J为NaAlO2,Al2O3电解后得到Al和O2,I与氢氧化钠溶液反应可知,I为Al,H为O2;F为红褐色沉淀,结合高中课本,可知为Fe(OH)3,由⑥反应可知,E为Fe(OH)2,结合C、D与反应⑤,可知C为FeCl3,D为FeCl2,B则为既有二价铁又有三价铁的氧化物,则为Fe3O4,同时就可推断A为Fe。
本题难度:一般
4、选择题 下列说法中正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.氧气和臭氧间的相互转化属于氧化还原反应
D.常温下,可以用铝制容器贮藏浓硫酸和浓硝酸,其原理相同
参考答案:A、氯化氢中含有共价键但不含离子键,虽然氯化氢溶于水能电离出H+、Cl-,但是氯化氢是共价化合物,故A错误.
B、碘晶体受热变成碘蒸气属于物理变化不是化学变化,吸收的热量用于克服分子间的作用力,不是用于克服碘原子间的作用力,故B错误.
C、氧气和臭氧间的相互转化属于化学反应,因为反应过程中没有元素化合价的变化,即没有电子的转移,所以不属于氧化还原反应,故C错误.
D、常温下,铝和铁能与浓硫酸或浓硝酸发生氧化还原反应而生成一层致密的氧化物薄膜,阻止了进一步的反应,即发生了钝化现象,所以常温下,可以用铝制容器贮藏浓硫酸和浓硝酸,其原理相同,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH溶液的体积为1L),则下列判断不正确的是? (? )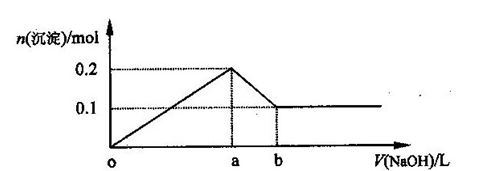
A.NaOH的浓度为0.6 mol/L
B.在a点处溶液中的溶质为NaCl
C.在b点处溶液中的溶质只有NaAlO2
D.图中线段oa : ab=5 : 1
参考答案:C
本题解析:从图像可知,Mg(OH)2的物质的量为0.1mol,Al(OH)3的物质的量为0.1mol,在b点共消耗NaOH 0.6mol,b处NaOH溶液的体积为1L,所以,NaOH的浓度为0.6 mol/L,A 正确。
在a点,Mg2+、Al3+都是以离子形式存在,溶液中阳离子只有Na+,故在a点处溶液中的溶质为NaCl,B 正确。
在b点处溶液中的溶质有NaAlO2和NaCl,C 错误。
oa段消耗OH-0.5mol,ab段消耗OH-0.1mol,故oa : ab=5 : 1? D正确。
本题难度:简单