时间:2019-07-04 00:37:48
1、选择题 在可逆反应中,改变下列条件一定能加快反应速率的是
A.增大反应物的量
B.升高温度
C.增大压强
D.使用催化剂
参考答案:B
本题解析:试题分析:在可逆反应中,升高温度一定加快反应速率,但压强和反应物的物质的量则是不一定的。如果使用负催化剂,反应速率降低,答案选B。
考点:考查外界条件对反应速率的影响
点评:该题是中等难度的试题,试题基础来源:91考试网 91ExAm.org性强,侧重对学生能力的培养。该题的关键是灵活运用外界条件对反应速率的影响,特别是条件的使用范围,有助于培养学生的逻辑推理能力和灵活应变能力。
本题难度:一般
2、选择题 电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0
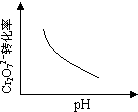
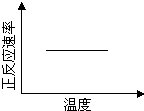
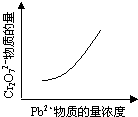
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是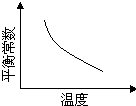 ?
?
A? B? C ? D
参考答案:A
本题解析:A、由△H<0,则正反应是一个放热的反应,升高温度平衡向吸热的方向移动,即向逆反应方向移动,由平衡常数为生成物浓度幂之积与反应物浓度幂之积,则K减小,故A正确;B、pH增大溶液碱性增强,会中和溶液中H+,降低生成物浓度,平衡向正方应方向移动,Cr2O72-的转化率会增大,与图中不符,故B错误;C、温度升高,正、逆反应速率都增大,与图中不符,故C错误;D、增大反应物Pb2+的浓度,平衡向正方应方向移动,则Cr2O72-的物质的量会减小,与图中不符,故D错误;故选:A。
本题难度:一般
3、选择题 反应3A(g)+B(g)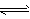 2C(g)+2D(g)在不同条件下,反应速率分别为
2C(g)+2D(g)在不同条件下,反应速率分别为
①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·s-1
④v(D)=0.45 mol·L-1·min-1
则此反应在不同条件下进行得最快的是
[? ]
参考答案:A
本题解析:
本题难度:简单
4、简答题 (14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)__________
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
参考答案:⑴C、 D;⑵①K=c(CH3OH)/c(CO)·c2(H2) ; ②△H<0;③250℃
⑶ CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)?ΔH=-725.76 kJ / mol
⑷ 负极CH3OH -6e-+8OH-=CO32-+6H2O ; 产生标准状况下的O216.8升
本题解析:A. CH3OH是生成物,而CO是反应物,在任何时刻都存在生成CH3OH的速率与消耗CO的速率相等,因此不能作为判断平衡的标志。错误。B. 由于反应是在体积固定的密闭容器中进行,反应前后遵循质量守恒定律,所以在无论反应是否达到平衡,混合气体的密度都不变。因此不能作为判断平衡的标志。错误。C. 由于该反应是个反应前后气体体积不等的可逆反应,若未达到平衡,气体的物质的量就要发生变化,则气体的密度也要发生变化,即混合气体的相对平均分子质量也要发生变化。因此混合气体的相对平均分子质量不变。可以作为判断反应达到平衡的标志。正确。D. 若反应达到平衡,反应混合物中CH3OH、CO、H2的任何一个组分的消耗浓度与产生浓度相等,即浓度都不再发生变化。因此可以作为判断反应达到平衡的标志。正确。⑵ ①化学平衡常数是可能反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。所以 。②由表中数据可知:升高温度,化学平衡常数减小。说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。逆反应方向为吸热反应方向,所以该反应的正反应为放热反应,△H<0。③CO(g)+2H2(g)
。②由表中数据可知:升高温度,化学平衡常数减小。说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。逆反应方向为吸热反应方向,所以该反应的正反应为放热反应,△H<0。③CO(g)+2H2(g) CH3OH(g)在反应开始时c(CO)=1mol/L;c(H2)=3mol/L;c(CH3OH)=0mol/L;当反应达到平衡时,C(CO)=0.2mol/L,所以根据方程式中各种物质的关系可知c(H2)=1.4mol/L;c(CH3OH)= 0.8mol/L化学平衡常数
CH3OH(g)在反应开始时c(CO)=1mol/L;c(H2)=3mol/L;c(CH3OH)=0mol/L;当反应达到平衡时,C(CO)=0.2mol/L,所以根据方程式中各种物质的关系可知c(H2)=1.4mol/L;c(CH3OH)= 0.8mol/L化学平衡常数 所以反应温度为250℃。(3)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时放出的热量。根据题目提供的数据可知:表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)? ΔH=-725.76 kJ / mol;(4)在燃料电池中,通入燃料的电极为负极,通入氧气的电极为正极。由于电解质为碱性,所以在负极的电极反应式为CH3OH -6e-+8OH-=CO32-+6H2O。n(CH3OH)=16g÷32g/mol=0.5mol.所以n(e-)=0.5mol×6=3mol.根据电子守恒可得n(O2)=3mol÷4=0.75mol,V(O2)= 0.75mol×22.4L/mol=16.8L。
所以反应温度为250℃。(3)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时放出的热量。根据题目提供的数据可知:表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)? ΔH=-725.76 kJ / mol;(4)在燃料电池中,通入燃料的电极为负极,通入氧气的电极为正极。由于电解质为碱性,所以在负极的电极反应式为CH3OH -6e-+8OH-=CO32-+6H2O。n(CH3OH)=16g÷32g/mol=0.5mol.所以n(e-)=0.5mol×6=3mol.根据电子守恒可得n(O2)=3mol÷4=0.75mol,V(O2)= 0.75mol×22.4L/mol=16.8L。
本题难度:一般
5、选择题 在一定条件下,一定量的A和B气体发生如下可逆反应: 2A(g)+3B(g)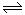 3C(g),只有反应到达平衡时才具有的性质是
3C(g),只有反应到达平衡时才具有的性质是
A.各物质的浓度之比为2:3:3
B.混合物各物质浓度的浓度相等
C.A、B、C三种物质的浓度不随时间变化而变化
D.ν(A)、ν(B)、ν(C) 之比为2:3:3
参考答案:C
本题解析:略
本题难度:简单