时间:2019-07-04 00:37:48
1、填空题 (14分)加大对煤燃烧产生的废气、废渣的处理已刻不容缓。
(1) 对燃煤的废气进行脱硝处理时,可利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=a kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH=b kJ·mol-1
则反应CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
(2) 将燃煤废气中的CO2转化为二甲醚的反应原理为: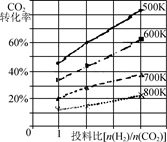
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
① 该反应平衡常数表达式为K=________。
② 已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填“>”“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”“减小”或“不变”)。
③ 二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为____________________________。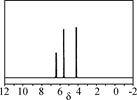
(3) 以CO2为原料合成的碳酸酯(仅含碳、氢、氧三种元素)是用途广泛的化学品,某种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色,右图为它的核磁共振氢谱图,请写出DPC的结构简式:____________。
(4) 某电厂的粉煤灰含莫来石(主要成分为Al6Si2O13、SiO2)。将其和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式(反应条件均为高温)为:
Al6Si2O13+3Na2CO3===2NaAlSiO4+4NaAlO2+3CO2↑
Al6Si2O13+5Na2CO3===2Na2SiO3+6NaAlO2+5CO2↑
SiO2+Na2CO3===Na2SiO3+CO2↑
则用1 mol Al6Si2O13和4 mol SiO2通过以上反应制得5 mol NaAlO2,共消耗Na2CO3为________mol。
2、选择题 在某恒温恒容的密闭容器内发生反应:2A(g)+B(g) C(g)?;ΔH<0 。开始充入2 mol A和2 mol B,并达到平衡状态,下列说法正确的是
C(g)?;ΔH<0 。开始充入2 mol A和2 mol B,并达到平衡状态,下列说法正确的是
A.再充入2 mol A,平衡正移,A的转化率增大
B.如果升高温度,C的体积分数增大
C.如果增大压强,平衡正移,B的体积分数减小
D.再充入1 mol C和1 mol B,C的体积分数将增大
3、计算题 在一定条件下,可逆反应A2+B2 2C,达到化学平衡状态,经测得平衡时:c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1,若A2,B2,C的起始浓度分别用a mol·L-1,b mol·L-1,c mol·L-1表示,要维持相同的平衡状态,请计算后完成下列问题:
2C,达到化学平衡状态,经测得平衡时:c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1,若A2,B2,C的起始浓度分别用a mol·L-1,b mol·L-1,c mol·L-1表示,要维持相同的平衡状态,请计算后完成下列问题:
(1)a、b应满足的关系是什么?
(2)计算a的取值范围。
4、选择题 反应A+3B==2C+D 在某段时间内以A 的浓度变化表示的反应速率为1 mol ·L-1·min-1,则此段时间内以C 的浓度变化表示的化学反应速率为
[? ]
A.0.5 mol·L-1·min-1
B.1 mol·L-1·min-1
C.2 mol·L-1·min-1
D.3 mol·L-1·min-1
5、填空题 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答: 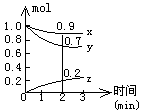
(1)计算反应开始2min内的Vx=______________, Vy=_________,Vz=________,
(2)容器内的反应物是__________________ 。
(3)写出该反应的化学方程式______________________。