时间:2019-07-04 00:33:53
1、选择题 在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) ?C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是:?(?)
?C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是:?(?)
A.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达到平衡时,途径I的和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径Ⅱ密度的1/2
参考答案:B
本题解析:根据反应的方程式可知,反应前后体积是不变的,A和B的物质的量之比相等,因此两容器中的平衡是等效的。所以选项B不正确,其余选项都是正确的,答案选B。
本题难度:一般
2、计算题 (8分)在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)  CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
参考答案:83.3%?逆反应
本题解析:设平衡时CO的转化率是x,则生成CO2和氢气的物质的量都是2x,消耗CO和水蒸气的物质的量是2x。由于化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以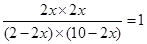 ,解得x=0.833,即转化率是83.3%。由于此时
,解得x=0.833,即转化率是83.3%。由于此时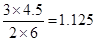 >1,所以反应向逆反应方向移动。
>1,所以反应向逆反应方向移动。
本题难度:一般
3、选择题 恒温、恒压下,a?mol?A和b?mol?B在一个容积可变的容器中发生如下反应:A(g)+2B(g)? 2C(g),一段时间后达到平衡,生成n?mol?C.则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n?mol?C.则下列说法中正确的是
[? ]
A.物质A、B的转化率之比为a∶b
B.起始时刻和达到平衡后容器中的压强比为(a+b)∶(a+b-n/2)
C.若起始时放入2a?mol?A和2b?mol?B,则达到平衡时生成2n?mol?C
D.当v正(A)=2v逆(B)时,可确定反应达到平衡
参考答案:C
本题解析:
本题难度:一般
4、计算题 (10分)某温度下,将氢气和碘蒸气各1mol的气态混合物充入10L的密闭容器中。发生反应H2(g)+I2(g)? =? 2HI(g)。2分钟后达到平衡后。测得C(H2)=0.08 mol.L-1,求(1)该反应的平衡常数。(2)2分钟内的H2的反应速率?(3)在上述温度下,该容器中若通入氢气和碘蒸气各3mol,求达到平衡后各物质的浓度(提示:K不变)。
参考答案:K=0.25? v(H2)=0.01mol·(L.min)-1 ?
C(H2)=c(I2)="0.24" mol·L-1? c(HI)= 0.12mol·L-1
本题解析:(1)平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。
H2(g)+I2(g) 2HI(g)
2HI(g)
起始量(mol)? 1? 1? 0
转化量(mol)? 0.2? 0.2? 0.4
平衡量(mol)? 0.8? 0.8? 0.4
所以其平衡常数为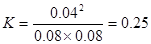
2分钟内的H2的反应速率为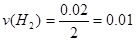 mol·(L.min)-1。
mol·(L.min)-1。
(2)? H2(g)+I2(g) 2HI(g)
2HI(g)
起始量(mol)? 3? 3? 0
转化量(mol)? x? x? 2x
平衡量(mol)? 3-x? 3-x? 2x
由于K值不变,所以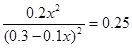
解得x=0.6mol
所以平衡后各物质的浓度分别为C(H2)=c(I2)="0.24" mol·L-1,c(HI)= 0.12mol·L-1。
本题难度:简单
5、选择题 已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
A.Q2<Q1<197 kJ·mol-1
B.Q2=Q1=197 kJ·mol-1
C.Q1<Q2<197 kJ·mol-1
D.Q2=Q1<197 kJ·mol-1
参考答案:A
本题解析:2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1表示每有2摩尔的SO2完全反应放出热量197kJ。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,由于该反应是可逆反应,不可能完全反应所以放出热量Q1<197 kJ。向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,,可以认为是已经有一部分反应物转化为产物,所以达到平衡时放出热量为Q2< Q1。故在这三种情况下的能量关系为Q2<Q1<197 kJ/mol.选项为 A.
2SO3(g) ΔH=-197 kJ·mol-1表示每有2摩尔的SO2完全反应放出热量197kJ。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,由于该反应是可逆反应,不可能完全反应所以放出热量Q1<197 kJ。向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,,可以认为是已经有一部分反应物转化为产物,所以达到平衡时放出热量为Q2< Q1。故在这三种情况下的能量关系为Q2<Q1<197 kJ/mol.选项为 A.
本题难度:一般