时间:2019-07-04 00:33:32
1、填空题 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化:A池________,B池_______,C池________。
⑶ 通过5min时,B中共收集224mL气体(标 况),溶液体积为200mL,则通电前硫酸铜溶
液的物质的量浓度为______________。
⑷ 若A中KCl溶液的体积也是200mL,电解后溶液的pH = ______。
参考答案:(10分)⑴ 负极(2分)?⑵ 增大,减小,不变 (各2分)?
⑶ 0.025mol/L? (1分)?⑷ 13(1分)
本题解析:⑴电解5min时铜电极质量增加2.16g,说明了在C中,铜极析出了银,故铜极为阴极,而Ag极为阳极,所以电源的X为负极,而Y为正极;⑵ A池为电解氯化钾溶液,其原理与电解食盐水一样,故A池的pH增大,而B中左边则析出铜,而右边则析出氧气,产生了大量的氢离子,所以B池的pH减小,而C池中银溶解而在铜极上析出,故C池的pH不变;⑶电解5min时铜电极质量增加2.16g,则该电路通过的电子为
2.16/108=0.02mol,B收集的气体为氧气和氢气的混合物,氧气为0.02/4=0.005mol,氢气的物质的量为0.224/22.4-0.005=0.005,所以析出铜的物质的量n=(0.02-0.005×2)/2=0.005mol,故通电前硫酸铜溶
液的物质的量浓度为0.005/0.2= 0.025mol/L;⑷ A中发生的反应为:2KCl+2H2O=H2↑+2KOH,该反应转移的电子数为2,但有0.02mol电子通过是,生成了0.02molKOH,所以氢氧根的浓度为0.02/0.2=0.1,所以电解后该溶液的pH为13。
点评:本题考查了电解池的判断,以及相关的计算,该考点是高考考查的重点和难点,本题的难度设计比较好,一步一步递增,该题难度中等。
本题难度:一般
2、选择题 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示。下列说法不正确的是
A.a 连接电源的正极
B.Li+ 的移动方向是从海水进入到盐酸中
C.过程中还可能获得有经济价值的副产物氢气和氯气
D.一段时间后,b电极附近溶液的pH降低
参考答案:D
本题解析:A. 根据题意要从海水中提取高浓度的锂盐,就要使海水中的Li+不断通过离子交换膜进入到左边的池中。根据同种电荷相互排斥,异种电荷相互吸引的原则,右边的电极b上应该负电荷较多,与电源的负极连接,则左边的a电极就要电源的正极连接,正确;在盐酸中含有的阳离子有H+, H+不断放电:2H++2e-=H2↑,为了维持平衡,Li+ 不断从海水进入到盐酸中,正确;C. 在过程中在a电极不断有Cl-放电产生Cl2,在b电极上,不断有H+放电产生H2,所以除了产生高浓度的锂盐,还可能获得有经济价值的副产物氢气和氯气,正确;D. 一段时间后,b电极附近溶液由于H+不断放电,c(H+)降低,所以附近溶液的pH升高,错误。
考点:考查电解原理的应用的知识。
本题难度:一般
3、填空题 (10分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO(g)+ 2H2(g) CH3OH (g)
CH3OH (g)
(1)下图表示反应中能量的变化。
①此反应的ΔH=___________。
②已知CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
(2)一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2。装置图如下所示:
①经测定,电子流动方向由b到a,则甲醇从_______(填“A”或“B”)口通入,该极的电极反应式为___________________。
②该电池工作一段时间后,正极附近的碱性____(填“增强”、“减弱”或“不变”)。
③用该电池电解(惰性电极)硝酸银溶液时,每消耗32 g CH3OH,生成银的质量为___ g。
参考答案:(1)①-90.9kJ?mol-1 ②CO2(g)+3H2(g) = CH3OH (g)+H2O(g) △H=-49.6kJ?mol-1
(2)①B CH3OH + 8OH-
本题解析:
本题难度:困难
4、选择题 已知A、B为单质,C为化合物。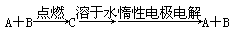
能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
参考答案:B
本题解析:①若A是Na,Na在氧气中燃烧生成过氧化钠,过氧化钠溶于水生成强碱NaOH,电解NaOH溶液相当于电解水,生成氢气和氧气,错误;②若A是H2,氢气在氯气中燃烧生成HCl,盐酸遇Na2CO3放出CO2,电解盐酸生成氢气和氯气,正确;③若B为Fe,Fe在氯气中燃烧生成FeCl3,FeCl3的溶液中滴加KSCN溶液显红色,电解FeCl3溶液生成氯化亚铁和氯气,错误;④若B为Cu,Cu在氯气中燃烧生成CuCl2,CuCl2的溶液中滴加NaOH溶液有蓝色沉淀生成,电解CuCl2溶液生成Cu和氯气,正确;选B。
考点:考查常见物质的相互转化。
本题难度:困难
5、选择题 下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽、接通电路后发现上
为电镀槽、接通电路后发现上 的c点显红色.为实现铁上镀锌,接通
的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是 
[? ]
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
参考答案:B
本题解析:
本题难度:一般