时间:2019-07-04 00:22:25
1、填空题 如图是某具有高效能的高铁电池的实验装置,已知放电后,两极得到铁的相同价态的化合物。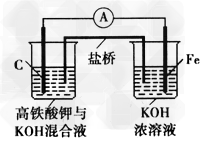
请问答下列问题: ?
(1)该电池放电时正极发生的电极反应是_________;若该电池属于二次电池,则充电时阴极的电极反应式为_________________ ?
(2)此盐桥中阴离子定向移动的方向是__________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是____。?
(3)高铁酸钾具有极姒的氧化性,是一种优良的水处理剂。请完成FeO42-?与水反应的化学方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。 ?
4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。 ?
(4)用适量的K2FeO4配制?=1.0?mol·L-1的试液,将试液分别置于20℃、40℃、60℃的恒温水浴中,测出?的变化如图I所示,则(3)中反应的△H_______0(填“>”、“<”或“=”),温度对该反应的反应速率和平衡移动的影响是_______________。? 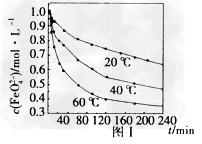
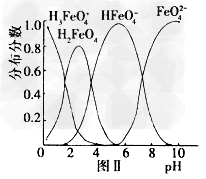
(5)?在水溶液中的存在形态如图Ⅱ所示。下列说法中正确的是___________。 ?
a.无论溶液的酸碱性如何变化,铁元素都有4种存在形态 ?
b.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-?的分布分数先增大后减小 ?
c.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O)
2、填空题 钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(
TiO2),TiO2常通过两种方法还原制得Ti。 
已知:2H2SO4+FeTiO3==TiOSO4+FeSO4 +2H2O. 回答下列问题:
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH=Na2SiO3+ H2O和___。
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是___。
(3) TiOSO4是一种强酸弱碱盐。从TiOSO4→H2TiO3需要加热,则加热的目的是____。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽。其阴极反应的电极反应式为___。
(5)因为反应TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) △H=+151 kJ.mol-1难于发生,所以工业上不能直接由TiO2和
TiCl4(l)+O2(g) △H=+151 kJ.mol-1难于发生,所以工业上不能直接由TiO2和
Cl2反应来制取TiCl4。当反应体系中加入炭粉后,反应分如下两步进行:
2C(s) +O2 ( g)=2CO( g) △H1= -221 kJ . mol-1
TiO2(s) +2C(s) +2Cl2(g) TiCl4 (l) +2CO( g) △H2 则△H2=____。
TiCl4 (l) +2CO( g) △H2 则△H2=____。
3、填空题 加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为________________;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极___________,阳极
____________。
4、填空题 目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点。
(1)?将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,完成并配平下列离子方程式 
(2)?用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为______________________
(3)?某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出): 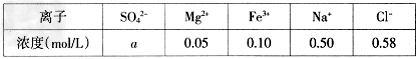
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下
注:离子的浓度小于?,可认为该离子不存在;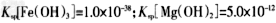 ;操作过程中溶液体积的变化忽略不计。
;操作过程中溶液体积的变化忽略不计。
①表格中的a_______0.16?(填“”或“=”)。
②沉淀A的组成为_______?(填化学式);在调节溶液PH时,理论上应调节的pH的范围是_____________________
③加入的过量试剂X为_______?(填化学式)。
④加入过量HCl的作用为______________
5、填空题 碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高,据估计我国患者大约有1 000万人。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐 中添加碘酸钾(KIO3),据此回答下列问题。
(1)碘是合成下列哪种激素的主要原料之一(? )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患(?)
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为___,氧化产物 与还原产物的物质的量之比为____,能观察到的明显现象是____。
(4)已知KIO3可用电解方法制得。原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温 度下电解KI溶液。总反应化学方程式为KI+ 3H2O KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
(5)在某温度下,若以12 A的电流强度电解KI溶液10 min,理论上可得标准状况下氢气___L。