时间:2019-07-04 00:20:09
1、填空题 盐是一类常见的电解质,事实表明盐的溶液不一定呈中性.
(1)CH3COONa、NH4Cl、KNO3?的水溶液分别呈______性、______性、______性.
(2)盐中阴、阳离子的水解使溶液呈现的酸碱性不同,它们水解的离子方程式的书写也不相同,如CH3COONa和NH4Cl?的水解的离子方程式分别为:______、______.
(3)盐类的水解在日常生活中也有一定的应用,如实验室配制FeCl3?溶液时常会出现浑浊,若要避免这种情况,则在配制时需要在蒸馏水中加入少量的______,目的是______.生活中,常用______溶液洗涤油污物品.
2、填空题 (14分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。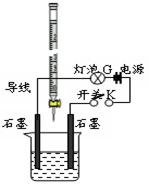
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_ _。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是_ _____(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
3、选择题 要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.丁学生:在醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的
B.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
C.乙学生:在盐酸中加入同温度的氨水,若混合液温度下降,说明盐类水解是吸热的
D.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
4、选择题 盐的水解程度大小可以用“水解度”来表示.关于NaA型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数.若测得2L1mol?L-1的强碱弱酸盐NaA溶液的pH为10,则A-离子(A-表示一元酸根离子)的水解度是( ? )
A.0.01%
B.0.1%
C.0.2%
D.1%
5、选择题 向一定量的某一元酸HA溶液中加入一定量强碱MOH溶液,反应后溶液呈中性,则下列判断中正确的是
A.反应中所用的酸过量
B.反应生成的盐不水解
C.参加反应的酸HA和碱MOH的物质的量相等
D.反应后的溶液中C(A-)=C(M+)