时间:2019-07-04 00:15:32
1、选择题 向盛有一定量氢氧化钠溶液的烧杯中通入标准状况下448mL氮气和二氧化碳的混合气体后得到溶液A,在溶液A中逐滴加入0.1 mol/L的稀盐酸至过量,并将溶液加热,产生的二氧化碳气体的物质的量与加入稀盐酸的体积的关系如图所示(忽略二氧化碳的溶解和氯化氢的挥发)。下列说法正确的是(?)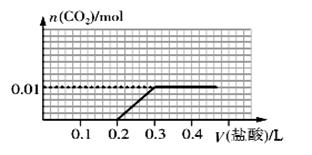
A.原混合气体中氮气与二氧化碳体积之比为1∶4
B.在逐滴加入稀盐酸产生二氧化碳之前,发生的离子反应为CO32-+H-==HCO3-
C.溶 液 A 中 含 有 0 . 01 mol NaOH 和0.01 mol Na2CO3
D.当加入0.1 L稀盐酸时,此时溶液中离子浓度大小关系为c(Na+)>c(Cl-)=c(CO32-)>c(OH-)>c(H+)
参考答案:C
本题解析:加入的盐酸是与氢氧化钠和碳酸钠溶液反应,反应放出0.01mol二氧化碳,可知原混合气体中含二氧化碳为0.01mol,由于混合气体共0.02mol,故二者体积比为1∶1,A选项错误;在产生二氧化碳之前,离子反应还包括与氢氧化钠的反应,故B错误;经过简单的计算,溶液A中含有0 . 01 mol NaOH 和0.01 mol Na2CO3,C正确;D错误,因为CO32-会发生水解,实际浓度就变小,故c(Na+)>c(Cl-)>c(CO32-)>c(OH-)>c(H+)。因此,本题选C。
点评:本题考查酸碱滴定和一些简单的计算,知道二氧化碳反应前后物质的量守恒是解题关键。
本题难度:简单
2、填空题 现有浓度均为0.1mol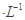 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(l)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是___________________
_____________________________________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是_________________(填序号)。
(3)将③和④按体积比l:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是________________________________________。
(4)已知t℃时,Kw=1×10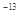 ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
参考答案:(1)④②③①(2分)
(2)⑥④⑤⑦(2分)
(3)c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)(2分)
(4)>;(2分)? 9:2(2分)
本题解析:(1)④的溶液中盐的水解对水的电离起促进作用,最大;酸碱溶液中对水的电离起抑制作用,但②的H+浓度最小,抑制作用小,①的H+浓度最大,抑制作用最大,所以四种溶液中由水电离出的浓度由大到小的顺序是④②③①;
(2)④中NH4+水解,Cl-不水解,⑤醋酸根离子对NH4+水解起促进作用,⑥硫酸氢铵电离产生的H+对NH4+水解起抑制作用,⑦只是一水合氨的电离产生NH4+,综上所述NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)将③和④按体积比l:2混合后,所得溶液为同浓度的氯化钠、氯化铵、一水合氨的混合液,溶液呈碱性,说明一水合氨的电离大于氯化铵的水解程度,所以混合液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)Kw是温度常数随温度升高而增大,1×10-13>1×10-14所以t℃>25℃;混合溶液的pH=2说明c(H+)=0.01mol/L,所以c(H+)×b- c(OH-)×a=0.01×(a+b),解得a:b=9:2
本题难度:一般
3、选择题 下列实验对应的图象正确的是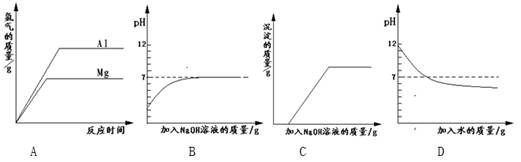 ?
?
A.将等质量的镁和铝分别与足量的盐酸反应
B.向pH=2的盐酸中滴加过量的氢氧化钠溶液
C.向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液
D.向pH=12的氢氧化钠溶液中加水稀释
参考答案:C
本题解析:A项:镁比铝活泼,镁的图线角度要大,故错;B项:氢氧化钠过量,最终溶液呈碱性,故错;D项:碱稀释不会变成酸,故错。故C。
点评:本题考查的是化学图像综合分析的相关知识,题目难度不大,注意碱再稀释也不会变成算。
本题难度:简单
4、选择题 下列操作后,溶液pH减小的是?(?)
A.适当升高Na2CO3溶液的温度
B.往氨水中加入NH4Cl固体
C.往氨水中加入CaCO3固体
D.用石墨作电极电解NaCl溶液
参考答案:B
本题解析:略
本题难度:简单
5、选择题 在25℃,将pH=11的NaOH溶液a mL与pH=1的H2SO4溶液b mL混合,当恰好完全中和时,a与b的比值为
A.1000:1
B.100:1
C.50: 1
D.10: 1
参考答案:B
本题解析:因为为强酸强碱的中和故有10-3mol/L×aml=10-1mol/L×bml;故有a:b=100:1。
本题难度:简单