时间:2019-07-04 00:14:00
1、选择题 在溶液中不能发生水解的离子是
A.HS-
B.CO32-
C.Fe3+
D.Br-
参考答案:D
本题解析:
本题难度:简单
2、填空题 (16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
参考答案:(16分)(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol(3分)
(2)(7分)①6.67 (3分) ②A(2分) ③< (2分)
(3)(6分)①NH4+(3分) ②c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)(3分)
本题解析:(1)根据题意可得热化学方程式:C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol;①根据图像和题意可知,在298k时,该反应达到平衡时,c(N2O4)="0.6mol/L," c(NO2)=0.3mol/L,所以该反应的平衡常数为K= L /mol; ②A.由于反应是在恒容的密闭容器内减小的,所以在任何时刻都存在混合气体的密度保持不变,一般不能判断反应达到平衡状态,错误; B.由于容器的容积不变,若混合气体的颜色不再变化,说明物质的浓度不变,反应达到平衡状态,正确; C.该反应的气体体积减小的反应,若未达到平衡状态,则气体的压强就会发生变化,因此气压恒定时,则反应处于平衡状态,正确。故选项是A;③若反应在298K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)<V(逆);(3)①NH4HSO4是强酸弱碱盐,弱碱阳离子NH4+水解消耗水电离产生的OH-,使溶液显酸性,而且NH4HSO4是强酸的酸式盐,电离也产生H+,使溶液显酸性。b点时,溶液中发生水解反应的离子是NH4+;②在c点时溶液呈中性,c(OH-)=c(H+),n(Na+)=0.015mol;n(SO)=0.01mol,由于NH4+会发生水解反应而消耗,所以n(NH4+)< 0.01mol,因为溶液的体积是相同的,所以微粒的物质的量越多,离子浓度就越大,因此c(Na+)> c(SO)>c(NH),在溶液中水电离程度很小,所以c(OH-)、c(H+)都很小,远小于盐电离产生的离子浓度,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
L /mol; ②A.由于反应是在恒容的密闭容器内减小的,所以在任何时刻都存在混合气体的密度保持不变,一般不能判断反应达到平衡状态,错误; B.由于容器的容积不变,若混合气体的颜色不再变化,说明物质的浓度不变,反应达到平衡状态,正确; C.该反应的气体体积减小的反应,若未达到平衡状态,则气体的压强就会发生变化,因此气压恒定时,则反应处于平衡状态,正确。故选项是A;③若反应在298K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)<V(逆);(3)①NH4HSO4是强酸弱碱盐,弱碱阳离子NH4+水解消耗水电离产生的OH-,使溶液显酸性,而且NH4HSO4是强酸的酸式盐,电离也产生H+,使溶液显酸性。b点时,溶液中发生水解反应的离子是NH4+;②在c点时溶液呈中性,c(OH-)=c(H+),n(Na+)=0.015mol;n(SO)=0.01mol,由于NH4+会发生水解反应而消耗,所以n(NH4+)< 0.01mol,因为溶液的体积是相同的,所以微粒的物质的量越多,离子浓度就越大,因此c(Na+)> c(SO)>c(NH),在溶液中水电离程度很小,所以c(OH-)、c(H+)都很小,远小于盐电离产生的离子浓度,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
考点:考查热化学方程式的书写、化学平衡状态的判断、化学平衡常数的计算、温度对化学平衡移动的影响、盐的水解、溶液中离子浓度的大小比较的知识。
本题难度:一般
3、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L CH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—)
C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S)
参考答案:D
本题解析:A项,考查物料守恒,CH3COOH部分电离产生CH3COO-和H+,醋酸根原子团守恒,得c(CH3COO-)+ c(CH3COOH)=0.1mol/L。B项,根据电荷守恒关系式C(Na+)+ c(H+)= 2 c(CO32—)+ c(HCO3—)+ c(OH-)和物料守恒关系式c(Na+)= c(CO32—)+ c(HCO3—)+ c(H2CO3),可计算得到c(OH-) = c(H+) + c(H2CO3)-c(CO32—)。C项,CH3COO-水解显碱性,所以c(Na+)> c(CH3COO-),c(OH-)> c(H+)。因为OH-是水解产生的,量很小,所以c(OH-)> c(H+)排在后边。D项,考查的物料守恒,c(Na+)=2 c(S)=2(c(S2—) + c(HS—)+ c(H2S))
本题难度:困难
4、选择题 下列根据反应原理设计的应用,不正确的是
[? ]
A.CO32-+H2O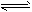 HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O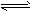 Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)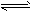 TiO2·xH2O↓+4HCl 制备TiO2纳米粉
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2O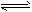 Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
参考答案:D
本题解析:
本题难度:一般
5、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)
B.c(H+)= c(OH—)
C.c(K+)=c(S2—)+c(HS—)+c(H2S)
D.c(OH-)=c(H+)+c(HS—)+2c(H2S)
参考答案:D
本题解析:A、根据电荷守恒可知c(K+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),A不正确;B、强碱弱酸盐水解溶液应呈碱性c(H+)<c(OH—),B不正确;C、根据物料守恒可知c(K+)=2c(S2-)+2c(HS-)+2c(H2S),C不正确;
D、根据质子守恒可知c(OH-)=c(H+)+c(HS-)+2c(H2S),D正确。
考点:了解盐类水解的原理、盐溶液酸碱性、影响盐类水解程度的主要因素、盐类水解的应用。
点评:主要考查对盐类水解判断溶液酸碱性、电解质溶液中三“守恒”等考点的理解。电荷守恒式注意关注离子电荷数,物料守恒重点是弄清所考查原子的个数比,质子守恒应重点分析H+与失去H+所得到的离子的去向。
本题难度:一般